Questões de Concurso
Filtrar
145 Questões de concurso encontradas
Página 9 de 29
Questões por página:
Questões por página:
Um químico preparou uma solução de Ba+2 comconcentração 0,025M. Inicia-se então umatitulação com 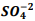 seguindo a reação: BαSO4(s) ⇔
seguindo a reação: BαSO4(s) ⇔ 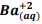 +
+ 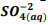 , onde Kps = [ Bα+2] [
, onde Kps = [ Bα+2] [ 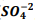 ] = 1,1 x10−10. Verifica-se que:
] = 1,1 x10−10. Verifica-se que:
I. A partir da concentração de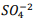 acima de0,025M inicia a precipitação de Ba+2. II. Em concentrações menores que 4,4 x10−9 M jáhouve precipitação de BαSO4.
acima de0,025M inicia a precipitação de Ba+2. II. Em concentrações menores que 4,4 x10−9 M jáhouve precipitação de BαSO4.
Assinale a alternativa correta:
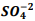 seguindo a reação: BαSO4(s) ⇔
seguindo a reação: BαSO4(s) ⇔ 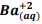 +
+ 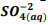 , onde Kps = [ Bα+2] [
, onde Kps = [ Bα+2] [ 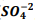 ] = 1,1 x10−10. Verifica-se que:
] = 1,1 x10−10. Verifica-se que: I. A partir da concentração de
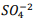 acima de0,025M inicia a precipitação de Ba+2. II. Em concentrações menores que 4,4 x10−9 M jáhouve precipitação de BαSO4.
acima de0,025M inicia a precipitação de Ba+2. II. Em concentrações menores que 4,4 x10−9 M jáhouve precipitação de BαSO4. Assinale a alternativa correta:
Considere a titulação de 100,0 ml do ácido acético 0,100M com hidróxido de sódio 0,100M:
CH3CO2H(aq) + OH-(aq) ⇔ CH3CO2-(aq) + H2O(l)
Para atingir o ponto de equivalência foram gastos 5,3 x10-6 M de OH- e o pH ficou em 8,72.
Analise as afirmativas a seguir e dê valores Verdadeiro (V) ou Falso (F).
( ) No ponto de equivalência o pH é neutro. ( ) No ponto de equivalência, o pH é ligeiramente básico, porém a partir desse ponto, a adição de mais NaOH torna a solução substancialmente básica.
Assinale a alternativa que apresenta a sequência correta de cima para baixo.
CH3CO2H(aq) + OH-(aq) ⇔ CH3CO2-(aq) + H2O(l)
Para atingir o ponto de equivalência foram gastos 5,3 x10-6 M de OH- e o pH ficou em 8,72.
Analise as afirmativas a seguir e dê valores Verdadeiro (V) ou Falso (F).
( ) No ponto de equivalência o pH é neutro. ( ) No ponto de equivalência, o pH é ligeiramente básico, porém a partir desse ponto, a adição de mais NaOH torna a solução substancialmente básica.
Assinale a alternativa que apresenta a sequência correta de cima para baixo.
Na reação heterogênea entre o superóxido de potássio e o gás carbônico, há a liberação de oxigênio, segundo a reação:
X KO2(s) + Y CO2(g) ⇔ W K2CO3(s) + Z O2(g).
Calcule a massa de KO2 necessária para reagir com 50 l de CO2 a 25°C e 1,0 atm. A massa molar do KO2 é 71,1 g/mol. Considere o volume molar 24,5l/mol.
Assinale a alternativa que contém os valores de X, Y, W e Z e a massa de KO2 consumida na reação.
X KO2(s) + Y CO2(g) ⇔ W K2CO3(s) + Z O2(g).
Calcule a massa de KO2 necessária para reagir com 50 l de CO2 a 25°C e 1,0 atm. A massa molar do KO2 é 71,1 g/mol. Considere o volume molar 24,5l/mol.
Assinale a alternativa que contém os valores de X, Y, W e Z e a massa de KO2 consumida na reação.
Calcule o volume de gás carbônico para que plantas produzam 1,00 g de glicose à 25°C e 1,0 atm.
Reação: 6CO2(g) + 6H2O(l) ⇔ C6H12O6(g) + 6O2(g).
Considere massa molecular da glicose = 180 g/mol e volume molar = 24,5 l/mol.
Assinale a alternativa que contém a resposta correta.
Reação: 6CO2(g) + 6H2O(l) ⇔ C6H12O6(g) + 6O2(g).
Considere massa molecular da glicose = 180 g/mol e volume molar = 24,5 l/mol.
Assinale a alternativa que contém a resposta correta.
Analise a seguinte situação: Misturou-se, em um balão de 1 l,0,10 mol de H2,0,10 mol de I2. Calcule a concentração no equilíbrio de todas as espécies em temperatura constante. Reação H2(g) + I2(g) ⇔ 2HI, onde K = 64.
Assinale a alternativa que contenha a concentração no equilíbrio de H2(g), I2(g) e HI respectivamente:
Assinale a alternativa que contenha a concentração no equilíbrio de H2(g), I2(g) e HI respectivamente: