Questões de Concurso
Filtrar
236 Questões de concurso encontradas
Página 29 de 48
Questões por página:
Questões por página:
Afórmula química do ácido clórico é:
Questão Anulada
A fórmula do ácido bromoso está corretamente mostrada na alternativa:
Assinale a alternativa que apresenta corretamente a quantidade de mL de solução de NaOH 1,0 M necessários para a neutralização de 100 mL de uma solução de HCl 0,5 M
A análise elementar quantitativa de 2,035 g de um composto orgânico oxigenado X forneceu 4,840 g de CO2 e 2,475 g de H2 O, por combustão. Verficou-se também que a referida massa de X ocupa um volume de 1,1275 L, a 227°C e 1atm de pressão. Dentre todos os possíveis isômeros, X é o único que possui enantiômeros. O número total de isômeros (constitucionais e estereoisômeros) com a fórmula molecular em questão e o nome do composto X estão respectivamente indicados em:
Uma amostra de 0,265 g de um antibiótico em pó foi dissolvida em HCl e completou-se o volume até 100,00 mL de solução. Uma alíquota de 25,00 mL foi transferida para um balão, seguida da adição de 25,00 mL de solução aquosa 0,018 mol.L–1 de KBrO3. Um excesso de KBr foi adicionado para formar Br2, segundo a equação a seguir: BrO3– + 5Br – + 6H+ → 3Br2 + 3H2O
O bromo formado reage com toda a sulfanilamida presente no antibiótico e, após um tempo, é adicionado excesso de KI, para reagir com o excesso de bromo, formando I2. Finalmente, o iodo formado é titulado, consumindo 13,00 mL de uma solução aquosa 0,12 mol.L–1 de tiossulfato de sódio. As demais equações químicas são:
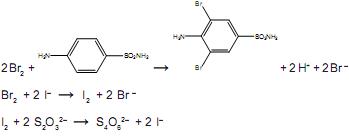
A porcentagem de sulfanilamida presente na amostra do antibiótico em pó é aproximadamente igual a:
Dado: Massa molar da sulfanilamida= 172 g. mol -1