Questões de Concurso
Filtrar
236 Questões de concurso encontradas
Página 30 de 48
Questões por página:
Questões por página:
A possibilidade de estabelecimento de ligação entre dois átomos pode ser de?nida em termos de um parâmetro denominado ordem de ligação (O.L), que pode ser determinada a partir do número de elétrons em orbitais ligantes e antiligantes em diagramas de energia dos orbitais, usando-se a Teoria dos Orbitais Moleculares (TOM). Considerando o parâmetro acima citado, a associação correta entre a molécula e sua ordem de ligação está presente em:
Dentre as exceções à regra do octeto, podemos citar exemplos de moléculas com número ímpar de elétrons (A), moléculas deficientes em elétrons (B) e moléculas com expansão de octeto (C). Assinale a alternativa em que aparecem moléculas dos tipos (A), (B) e (C), respectivamente.
Quando uma amostra de 4,0 g de bicarbonato de sódio (NaHCO3) é posta em contato com acido clorídrico (HCl), libera 0,96 L de CO2, medido a 273 K e 1 atm? A equação que descreve a reação é a seguinte: NaHCO3 + HCl → NaCl + H2O + CO2 Podemos afirmar que o grau de pureza da amostra de bicarbonato de sódio é
A reação de Sabatier envolve a reação do hidrogênio com o dióxido de carbono em temperaturas e em pressões elevadas na presença de um catalisador de níquel, cujo resultado final é metano e água. A reação de Sabatier é descrita pela seguinte equação: CO2 (g) + 4 H2 (g) 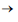 CH4 (g) + 2 H2O(l)
CH4 (g) + 2 H2O(l)
Esta reação, descoberta pelo químico francês Paul Sabatier, tem sido estudada para remover CO2 de atmosferas artificiais como em espaçonaves. Considerando que um indivíduo libere para o ambiente 0,6 kg de dióxido de carbono por dia, e que 80% desse gás será removido pelo processo de Sabatier, a massa de metano produzida por dia é de Dados: Massas Molares: H = 1g.mol-1 C = 12g.mol-1 O=16g.mol-1
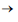 CH4 (g) + 2 H2O(l)
CH4 (g) + 2 H2O(l) Esta reação, descoberta pelo químico francês Paul Sabatier, tem sido estudada para remover CO2 de atmosferas artificiais como em espaçonaves. Considerando que um indivíduo libere para o ambiente 0,6 kg de dióxido de carbono por dia, e que 80% desse gás será removido pelo processo de Sabatier, a massa de metano produzida por dia é de Dados: Massas Molares: H = 1g.mol-1 C = 12g.mol-1 O=16g.mol-1
O óxido nitroso, também conhecido como o gás do riso, foi usado como anestésico e hoje é vendido em pequenas cápsulas para preparação de espumas na culinária. Os jovens, hoje, inalam esse gás e sentem um leve torpor e em seguida euforia, embora ainda não se saiba os efeitos colaterais do seu uso prolongado. Acredita-se que pode levar à dependência. O óxido citado no texto pode ser representado pela fórmula