Questões de Concurso
Filtrar
110 Questões de concurso encontradas
Página 18 de 22
Questões por página:
Questões por página:
Com relação a reações químicas e a substâncias, julgue o item subsequente.
A concentração de uma solução é dada pela quantidade de matéria por litro de solução.
Uma amostra de 0,265 g de um antibiótico em pó foi dissolvida em HCl e completou-se o volume até 100,00 mL de solução. Uma alíquota de 25,00 mL foi transferida para um balão, seguida da adição de 25,00 mL de solução aquosa 0,018 mol.L–1 de KBrO3. Um excesso de KBr foi adicionado para formar Br2, segundo a equação a seguir: BrO3– + 5Br – + 6H+ → 3Br2 + 3H2O
O bromo formado reage com toda a sulfanilamida presente no antibiótico e, após um tempo, é adicionado excesso de KI, para reagir com o excesso de bromo, formando I2. Finalmente, o iodo formado é titulado, consumindo 13,00 mL de uma solução aquosa 0,12 mol.L–1 de tiossulfato de sódio. As demais equações químicas são:
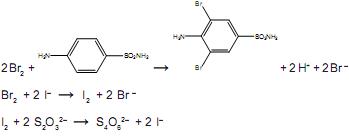
A porcentagem de sulfanilamida presente na amostra do antibiótico em pó é aproximadamente igual a:
Dado: Massa molar da sulfanilamida= 172 g. mol -1
O peróxido de hidrogênio (H2 O2 ) é muito usado em reações de óxido-redução (ou redox), já que pode atuar como agente oxidante ou redutor. É vendido comercialmente na forma de soluções aquosas de diferentes concentrações. Em uma análise para determinar a concentração de uma amostra,5,10 g de uma água oxigenada comercial foram diluídos com água até 250 mL. Uma alíquota de 25 mL da mesma solução foi titulada por uma solução básica de cloreto de cromo III (CrCl 3 ), conforme a equação não balanceada abaixo:
CrCl 3 (aq) + NaOH (aq) + H2 O 2 (aq) → NaCl (aq) + Na2 CrO 4 (aq) + H2 O (l)
Sabendo que foram gastos 50,00 mL de solução básica de CrCl 3 de concentração 0,01 mol.L-1 , a porcentagem em massa (% m) de peróxido de hidrogênio na amostra de água oxigenada é igual a:
CrCl 3 (aq) + NaOH (aq) + H2 O 2 (aq) → NaCl (aq) + Na2 CrO 4 (aq) + H2 O (l)
Sabendo que foram gastos 50,00 mL de solução básica de CrCl 3 de concentração 0,01 mol.L-1 , a porcentagem em massa (% m) de peróxido de hidrogênio na amostra de água oxigenada é igual a:
O ácido benzoico foi descoberto no século XVI e recebeu esse nome por ter sido extraído do benjoeiro. Em 1875, Salkowski verificou que esse ácido atua como fungicida e, desde então, o ácido benzoico vem sendo usado como germicida na preservação de alimentos e como adjuvante farmacológico anti-fúngico, normalmente em concentrações que variam entre 0,05 a 0,15%. Trata-se de um composto de fórmula molecular C7H6O2 (massa molar = 122 g.mol -1 ) pouco solúvel em água. Em uma solução aquosa, comporta-se como um ácido fraco, com pKa = 4. Uma solução aquosa de ácido benzoico em concentração 0,12% (m/v) apresenta pH aproximadamente igual a
A análise da concentração de ortofosfato em corpos d’água pode ser feita utilizando o método colorimétrico. Nesse método, o reagente combinado contendo K(SbO)C4H4O6, (NH4 )6Mo7O24 e ácido ascórbico reage em meio ácido com o ortofosfato, produzindo uma cor azul, cuja intensidade é determinada no espectrofotômetro. No preparo de 100 mL do reagente combinado utiliza-se 5 mL de uma solução de K(SbO)C4H4O6 3,5 g.L-1 e 15 mL de uma solução de (NH4 )6Mo7O24 40 g.L-1 . Nessa solução do reagente combinado as concentrações aproximadas (em g.L-1 ) de K(SbO)C4H4O6 e de (NH4 )6Mo7O24 são, respectivamente,