Filtrar
8 Questões de concurso encontradas
Página 1 de 2
Questões por página:
A entalpia de combustão é uma diferença de entalpia (ΔH) observada na reação química entre um mol de uma substância (o combustível) e o oxigênio (o comburente), formando gás carbônico e vapor de água.
O gráfico a seguir apresenta a entalpia de combustão, em certa temperatura, para o etano, o propano, o butano, o pentano e o hexano. 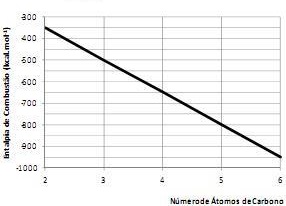
De acordo com o gráfico pode-se estimar que:
A energia de dissociação de ligação é uma medida da força da ligação química. É definida como a mudança de entalpia padrão observada na quebra homolítica de uma ligação a 0 K. A inclusão de correções térmicas leva os valores de energia de dissociação à entalpia padrão de dissociação, definidos a 298 K.
O diagrama de energia a seguir apresenta as variações de entalpia, a 298 K, para diversos processos. 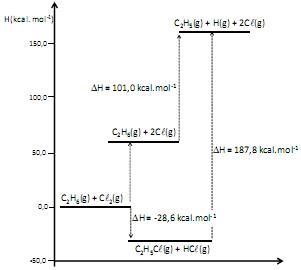
A diferença de entalpia, a 298 K, expressa em kcal.mol –1 , observada na cisão homolítica de 1 mol de ligações Cl-Cl é de