Questões de Concurso
Filtrar
73 Questões de concurso encontradas
Página 11 de 15
Questões por página:
Para determinar a equação de velocidade correspondente a um dado mecanismo, são feitos os seguintes passos:
01. Localizar a etapa lenta no mecanismo. A velocidade da reação global será a velocidade desta etapa.
02. Escrever a equação de velocidade para a etapa lenta. Para isso, é notado que o expoente de um reagente na equação de velocidade para uma etapa é seu coeficiente na equação para essa etapa.
03. Se a equação de velocidade obtida em 02 contiver um intermediário instável, o termo dessa espécie deve ser eliminado. Frequentemente, isto pode ser feito trabalhando-se com a constante de equilíbrio para uma etapa rápida no mecanismo.
De acordo com as informações anteriores, assinale a alternativa que corresponde aos passos para a determinação da equação de velocidade.
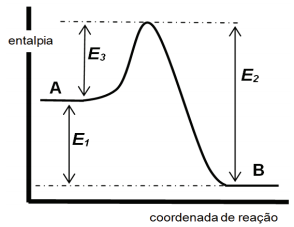 ( ) corresponde à entalpia da reação direta ( ) corresponde à energia de ativação da reação direta ( ) corresponde à entalpia da reação inversa ( ) corresponde à energia de ativação da reação inversa
( ) corresponde à entalpia da reação direta ( ) corresponde à energia de ativação da reação direta ( ) corresponde à entalpia da reação inversa ( ) corresponde à energia de ativação da reação inversa Assinale a alternativa correta:
Assinale a alternativa correta: