Concurso:
MPU
Disciplina:
Engenharia Química
Em um estudo de cinética química para obter-se a energia de ativação de uma reação, dez experimentos foram feitos determinando-se a constante da taxa de reação em temperaturas distintas. Os resultados obtidos foram plotados na forma: 1/T (inverso da temperatura em K) vs ln(k) (logaritmo da constante da taxa de reação), obtendose uma correlação linear:
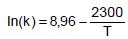 . Determine a energia de ativação da reação com base na correlação apresentada, sabendo que esta reação segue a equação de Arrhenius.
. Determine a energia de ativação da reação com base na correlação apresentada, sabendo que esta reação segue a equação de Arrhenius.
Dados: R = 8,314 J/mol K