A intensidade das forças intermoleculares em diferentes substâncias varia em uma grande faixa, mas essas forças são muito mais fracas que as ligações iônicas e covalentes. Dessa forma, é necessário menos energia para vaporizar um líquido ou fundir um sólido do que quebrar ligações covalentes em moléculas.
Ponto de ebulição dos hidretos do grupo 4A e 6A em função da massa molecular.
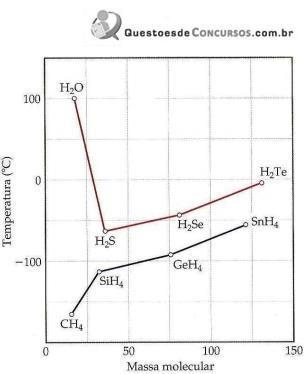
(Química Ciência Central.)
Sobre a imagem e intensidade das forças intermoleculares, analise.
I. No geral, o ponto de ebulição de compostos de hidrogênio torna-se maior com o aumento da massa molecular, devido ao acréscimo das forças de dispersão.
II. Os compostos NH3 e HF também têm pontos de ebulição altos.
III. A ligação de hidrogênio é um tipo de atração intermolecular entre o átomo de hidrogênio em uma ligação apolar (particularmente uma ligação com F, O ou N) e um par de elétrons não compartilhado em um íon ou átomo pequeno e eletronegativo que esteja próximo (geralmente um átomo de F, O ou N em outra molécula).
Está(ão) correta(s) apenas a(s) afirmativa(s)
Ponto de ebulição dos hidretos do grupo 4A e 6A em função da massa molecular.

(Química Ciência Central.)
Sobre a imagem e intensidade das forças intermoleculares, analise.
I. No geral, o ponto de ebulição de compostos de hidrogênio torna-se maior com o aumento da massa molecular, devido ao acréscimo das forças de dispersão.
II. Os compostos NH3 e HF também têm pontos de ebulição altos.
III. A ligação de hidrogênio é um tipo de atração intermolecular entre o átomo de hidrogênio em uma ligação apolar (particularmente uma ligação com F, O ou N) e um par de elétrons não compartilhado em um íon ou átomo pequeno e eletronegativo que esteja próximo (geralmente um átomo de F, O ou N em outra molécula).
Está(ão) correta(s) apenas a(s) afirmativa(s)