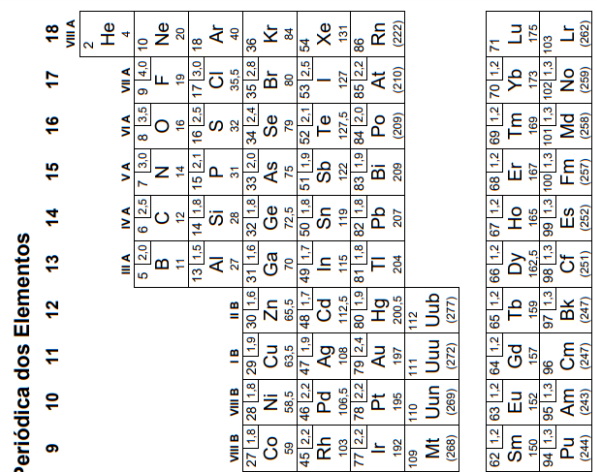
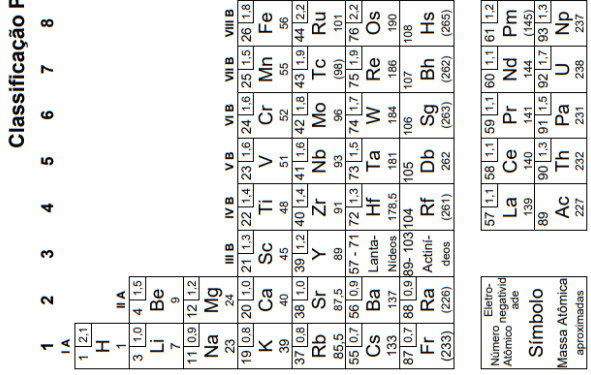
mostrar texto associado
O ácido nítrico (HNO3) é uma importante matéria-prima na indústria química. Sua produção comercial ocorre através da conversão da amônia (NH3) em uma sequência de três etapas denominada Processo de Ostwald. Na primeira etapa, ocorre a oxidação catalítica da amônia:
4NH3(g) + 5O2(g) → 4NO(g) + 6H2O(g)
Na segunda etapa, o óxido nítrico (NO) formado, quando exposto ao ar, se oxida rapidamente dando origem ao dióxido de nitrogênio (NO2):
2NO(g) + O2 → 2NO2(g)
Na terceira etapa, o NO2, quando dissolvido em água, forma o ácido nítrico como descrito na reação a seguir:
3NO2(g) + H2O(l) → 2HNO3(aq) + NO(g)
A quantidade máxima de ácido nítrico, em kg, que pode ser obtida a partir de 10.000 L de amônia é igual a
(Dado: volume molar = 25,0 L.mol-1)
4NH3(g) + 5O2(g) → 4NO(g) + 6H2O(g)
Na segunda etapa, o óxido nítrico (NO) formado, quando exposto ao ar, se oxida rapidamente dando origem ao dióxido de nitrogênio (NO2):
2NO(g) + O2 → 2NO2(g)
Na terceira etapa, o NO2, quando dissolvido em água, forma o ácido nítrico como descrito na reação a seguir:
3NO2(g) + H2O(l) → 2HNO3(aq) + NO(g)
A quantidade máxima de ácido nítrico, em kg, que pode ser obtida a partir de 10.000 L de amônia é igual a
(Dado: volume molar = 25,0 L.mol-1)