Questões do concurso:
Prefeitura de Santos - 2023 - INSTITUTO MAIS - 2023 - Prefeitura de Santos - SP - Engenheiro Químico
limpar filtros
50 Questões de concurso encontradas
Página 3 de 10
Questões por página:
Questões por página:
Concurso:
Prefeitura de Santos
Disciplina:
Engenharia Química e Química Industrial
Ao medir alcalinidade, os resultados são normalmente expressos como ppm (ou mg/L) de Carbonato de Cálcio (CaCO3). Íons de hidróxido (OH– ), íons de Bicarbonato (HCO3– ) e íons de Carbonato (CO3 2- ) também contribuem para a alcalinidade da água. A mesma unidade de medida pode ser indicadora da concentração dos íons de Ca2+ . Cátions como Ca2+ e Mg2+ devem ser controlados em águas recebidas para processos industriais, pois são fonte de sais de “dureza”. Sua presença em sistemas geradores de vapor pode ser danosa, já que sais desses cátions tendem a formar incrustrações e pontos de aderência em caldeiras e linhas de condução de vapor, prejudicando sua eficiência de troca térmica, gerando pontos de superaquecimento na tubulação e gastando mais combustível no processo. Isso se deve aos precipitados de carbonatos e sulfatos de Cálcio e Magnésio, insolúveis em água.
A melhor solução para esse problema está na prevenção, retirando tais cátions no processo de tratamento de água. Os 2 principais tratamentos usados para garantir a qualidade da água a ser usada nas caldeiras são:
- Tratamento com fosfatos, que precipitam os sais de cálcio e magnésio, formando um lodo no fundo da caldeira que pode ser facilmente purgado;
- Tratamento com quelatos (como EDTA, por exemplo). Formam-se complexos solúveis com cálcio e magnésio, permitindo a indisponibilização dos mesmos para atacar as paredes das tubulações e da caldeira.
Em escala de laboratório, é comum se trabalhar com água deionizada por passagem em resinas de troca iônica ou até mesmo com água destilada, quando se precisa remover a dureza da água de trabalho. Sobre essa mudança de procedimentos de trabalho entre a escala de laboratório e a escala industrial, é correto afirmar que
A melhor solução para esse problema está na prevenção, retirando tais cátions no processo de tratamento de água. Os 2 principais tratamentos usados para garantir a qualidade da água a ser usada nas caldeiras são:
- Tratamento com fosfatos, que precipitam os sais de cálcio e magnésio, formando um lodo no fundo da caldeira que pode ser facilmente purgado;
- Tratamento com quelatos (como EDTA, por exemplo). Formam-se complexos solúveis com cálcio e magnésio, permitindo a indisponibilização dos mesmos para atacar as paredes das tubulações e da caldeira.
Em escala de laboratório, é comum se trabalhar com água deionizada por passagem em resinas de troca iônica ou até mesmo com água destilada, quando se precisa remover a dureza da água de trabalho. Sobre essa mudança de procedimentos de trabalho entre a escala de laboratório e a escala industrial, é correto afirmar que
Concurso:
Prefeitura de Santos
Disciplina:
Engenharia Química e Química Industrial
Alcalinidade total e pH são conceitos inter-relacionados, mas diferentes. O pH mede a concentração de íons H+ ou de OH- indicando o quanto uma solução é ácida ou básica, em uma escala absoluta e de crescimento exponencial. Por sua vez, a alcalinidade total indica quanto ácido ou base a solução pode absorver sem alterar de forma impactante seu pH. Em outras palavras, a alcalinidade total mede a capacidade de tamponamento de uma solução, uma certa elasticidade em absorver ácidos sem impactar os valores de pH. Essa capacidade de tamponamento é extremamente importante para a manutenção da vida, e é comum encontrarmos muitos exemplos de soluções tamponadas nos sistemas biológicos. Em fontes naturais de água, a alcalinidade varia de acordo com a geologia do local. Os minerais das rochas mais próximas e a permeação do solo influenciam dramaticamente a alcalinidade das águas adjacentes. Por exemplo, áreas com predominância de rochas de calcário terão uma alcalinidade maior em suas águas do que áreas com predominância de rochas graníticas. Ao medir alcalinidade, os resultados são normalmente expressos como ppm (ou mg/L) de Carbonato de Cálcio (CaCO3). Íons de hidróxido (OH– ), íons de Bicarbonato (HCO3 – ) e íons de Carbonato (CO3 2- ) também contribuem para a alcalinidade da água. Diante do exposto, pode-se afirmar que o(a)
Concurso:
Prefeitura de Santos
Disciplina:
Engenharia Química e Química Industrial
Quando se observam os catalizadores automobilísticos, vê-se que ajudam a promover a queima completa de vários gases que deixam o motor em reações de oxidação incompletas. Eles são fundamentais para a melhoria da qualidade do ar em grandes cidades, pois podem reduzir as emissões de gases altamente poluentes em até 80%. Exemplo: Óxido de Nitrogênio, Monóxido de Carbono, Hidrocarbonetos diversos. Sua temperatura ideal de atuação catalítica gira ao redor de 400 °C até 800 °C. Os catalizadores são estruturas complexas, compostas por uma base cerâmica, com área cheia de microvilosidades, recobertos por diferentes materiais ativos, capazes de gerar sinergias entre eles. Por exemplo, a Platina é um metal nobre que atua melhor em ambientes com abundância de O2, oxidando os gases poluente de forma sequencial. Já em ambientes ou momentos com menor disponibilidade de oxigênio, o Ródio entra em ação, catalisando outros mecanismos de reação para formar gases menos poluentes. A presença desses metais encarece o acessório dos veículos, mas a durabilidade pode se estender a toda a vida útil do automóvel, já que o catalisador nunca é consumido na reação.
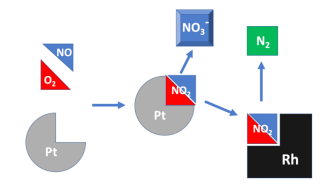
O mecanismo típico de catálise heterogênea envolve os seguintes passos:

O mecanismo típico de catálise heterogênea envolve os seguintes passos:
Concurso:
Prefeitura de Santos
Disciplina:
Engenharia Química e Química Industrial
O tratamento de água para linhas de vapor pode ser dividido em 3 partes: desaeração em “flasheamento”, tratamento químico e purgas. Sobre o processo de purga, assinale a alternativa correta.
Concurso:
Prefeitura de Santos
Disciplina:
Química
Considere os dados de massas atômicas e as massas molares abaixo para responder à questão.
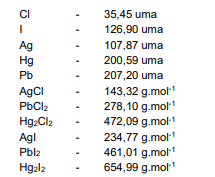
O cloreto branco da questão anterior, que havia sido totalmente precipitado por solução HCl diluído, foi depois redissolvido em solução aquosa por aquecimento em banho-maria. O íon foi novamente precipitado, agora pela ação de uma solução de Iodeto de Potássio (KI), gerando um sal amarelo. Esse novo sal, foi filtrado, separado, seco e pesado em balança analítica, totalizando 9,22 g do sal de Iodeto para cada litro da amostra original. Assinale a alternativa que apresenta a concentração molar desse íon encontrado na solução amostra original.