Questões de Concurso
Filtrar
135 Questões de concurso encontradas
Página 10 de 27
Questões por página:
Questões por página:
Com o objetivo de analisar o processo de dissolução de um sólido num líquido, um estudante de Química realizou uma pequena experiência. Adicionou 20,0 g de sulfato de cálcio a um béquer contendo 200 mL de água destilada a 30 °C e com um termômetro observou a variação da temperatura durante a dissolução. Notou que a temperatura da solução diminuiu. Ele ainda observou que a amostra de sal não se dissolveu completamente. Por isso, filtrou a mistura e mediu a massa do filtrado (precipitado) depois de seco; tendo obtido 6,50 g.
Com base nas informações obtidas pelo aluno, por meio do experimento descrito acima, indique a alternativa que apresenta uma conclusão INCORRETA a respeito deste experimento.
Com base nas informações obtidas pelo aluno, por meio do experimento descrito acima, indique a alternativa que apresenta uma conclusão INCORRETA a respeito deste experimento.
Os valores de pH e pOH de um sistema refletem as concentrações dos íons H1+ e OH1-, respectivamente, informando sobre o nível de acidez do meio.
Com base nas informações da tabela abaixo, assinale a alternativa CORRETA.
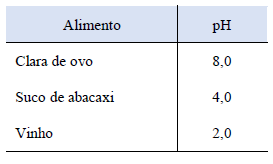
Com base nas informações da tabela abaixo, assinale a alternativa CORRETA.

O ácido acetilsalicílico é um fármaco do grupo anti‐inflamatórios não esteroides utilizado como anti‐inflamatório, antipirético e também como antiplaquetário. Um dos medicamentos mais famosos à base de ácido acetilsalicílico é a aspirina.
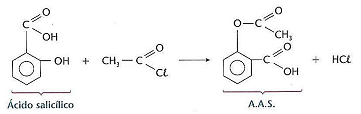
De acordo com o exposto, analise as afirmativas a seguir.
I. Na reação apresentada anteriormente o nome oficial do haleto de acila e do ácido salicílico é cloreto de etanoíla e ácido 2‐hidróxi‐benzóico.
II. Uma solução de 0,015 mol/L de aspirina com pH = 3 possui uma constante de dissociação ácida igual a 1,3 x 10–3.
III.A porcentagem de ácido ionizada na solução de 0,20 mol/L de aspirina com pH = 5 é 1,7%.
Está(ão) correta(s) a(s) afirmativa(s)

De acordo com o exposto, analise as afirmativas a seguir.
I. Na reação apresentada anteriormente o nome oficial do haleto de acila e do ácido salicílico é cloreto de etanoíla e ácido 2‐hidróxi‐benzóico.
II. Uma solução de 0,015 mol/L de aspirina com pH = 3 possui uma constante de dissociação ácida igual a 1,3 x 10–3.
III.A porcentagem de ácido ionizada na solução de 0,20 mol/L de aspirina com pH = 5 é 1,7%.
Está(ão) correta(s) a(s) afirmativa(s)
Normalmente, a medida de pH de uma solução aquosa pode ser feita com o auxílio de um peagâmetro, que mede a diferença de potencial elétrico existente e possui uma escala já graduada em valores de pH ou de um indicador ácido‐base, que são substâncias orgânicas de fórmulas complexas e possuidoras de um caráter de ácido fraco ou de base fraca. O pH das soluções NaNO2 0,10 mol/L, Ka = 4,5 x 10–4 e NH4Br 0,25 mol/L, Kb = 1,8 x 10–5 são, respectivamente:
(Dados: log 1,49 = 0,17 e log 1,18 = 0,07.)
(Dados: log 1,49 = 0,17 e log 1,18 = 0,07.)
O sangue é vital para o funcionamento do organismo. Para que as trocas gasosas ocorram normalmente, o sangue deve estar tamponado com pH em torno de 7,4. O principal sistema tampão usado para controlar o pH no sangue é o sistema tampão ácido carbônico‐bicarbonato.
H+ (aq) + HCO– 3(aq)↔ H2CO3(aq) ↔ H2O(l) + CO2(g)
A regulagem do pH do plasma sanguíneo relaciona‐se diretamente ao transporte efetivo de O2 para os tecidos corpóreos. O oxigênio é carregado pela proteína hemoglobina encontrada nas células de glóbulos vermelhos. A hemoglobina (Hb) liga‐se reversivelmente tanto ao H+ quanto ao O2.
HbH+ + O2↔ HbO2 + H+
De acordo com as reações apresentadas, marque V para as afirmativas verdadeiras e F para as falsas.
( ) Durante períodos de esforço vigoroso grandes quantidades de CO2 são produzidas pelo metabolismo, que desloca o equilíbrio para a direita, diminuindo o pH.
( ) Quando o sangue atinge os tecidos nos quais a concentração de O2 é baixa, o equilíbrio desloca‐se para a esquerda e O2 é liberado.
( ) Durante períodos de esforço vigoroso, à medida que O2 é consumido, o equilíbrio desloca‐se para a direita de acordo com o princípio de Le châtelier.
( ) A remoção de CO2 por exalação desloca o equilíbrio para a direita, consumindo íons H+ .
A sequência está correta em
H+ (aq) + HCO– 3(aq)↔ H2CO3(aq) ↔ H2O(l) + CO2(g)
A regulagem do pH do plasma sanguíneo relaciona‐se diretamente ao transporte efetivo de O2 para os tecidos corpóreos. O oxigênio é carregado pela proteína hemoglobina encontrada nas células de glóbulos vermelhos. A hemoglobina (Hb) liga‐se reversivelmente tanto ao H+ quanto ao O2.
HbH+ + O2↔ HbO2 + H+
De acordo com as reações apresentadas, marque V para as afirmativas verdadeiras e F para as falsas.
( ) Durante períodos de esforço vigoroso grandes quantidades de CO2 são produzidas pelo metabolismo, que desloca o equilíbrio para a direita, diminuindo o pH.
( ) Quando o sangue atinge os tecidos nos quais a concentração de O2 é baixa, o equilíbrio desloca‐se para a esquerda e O2 é liberado.
( ) Durante períodos de esforço vigoroso, à medida que O2 é consumido, o equilíbrio desloca‐se para a direita de acordo com o princípio de Le châtelier.
( ) A remoção de CO2 por exalação desloca o equilíbrio para a direita, consumindo íons H+ .
A sequência está correta em