Questões da prova:
Cebraspe (cespe) - 2022 - PC-RO - Datiloscopista Policial
limpar filtros
100 Questões de concurso encontradas
Página 10 de 20
Questões por página:
Questões por página:
Em algumas regiões brasileiras, o café faz parte de todas as refeições e uma das maneiras de prepará-lo é colocar a água no fogo juntamente com açúcar e o pó, até que seja formada a mistura desses componentes. Para que seja ingerido, basta passá-la pelo coador.
Considerando o preparo do café conforme essa descrição, assinale a opção correta.
Considerando o preparo do café conforme essa descrição, assinale a opção correta.
Recentemente, um britânico de 23 anos de idade morreu por overdose de cafeína (C8H10N4O2). Na necropsia, foi constatado que havia o equivalente a 70 latas de energético em seu organismo, sendo a dose de cafeína em cada lata equivalente a 30 mg.
Com base nessa situação e considerando-se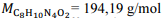 a massa molar da cafeína e
a massa molar da cafeína e 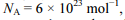 a constante de Avogadro, é correto concluir que o número de moléculas de cafeína ingeridas pelo britânico é
a constante de Avogadro, é correto concluir que o número de moléculas de cafeína ingeridas pelo britânico é
Com base nessa situação e considerando-se
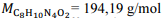 a massa molar da cafeína e
a massa molar da cafeína e 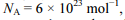 a constante de Avogadro, é correto concluir que o número de moléculas de cafeína ingeridas pelo britânico é
a constante de Avogadro, é correto concluir que o número de moléculas de cafeína ingeridas pelo britânico é Considerando-se que, para titular completamente 10 mL de uma solução de ácido sulfúrico (H2SO4), tenham sido utilizados 15 mL de uma solução 1,2 mol/L de hidróxido de sódio (NaOH), conclui-se que a concentração em quantidade de matéria do ácido sulfúrico na solução analisada seria igual a
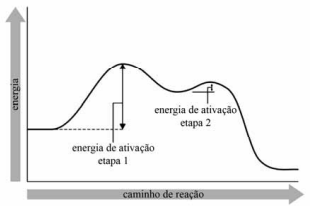
A reação de decomposição da amônia (NH3) pode produzir hidrazina (N2H4) e gás hidrogênio (H2), conforme a equação química que se segue.
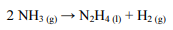
Essa reação ocorreu a partir de 0,07 m3 de uma mistura gasosa que possui 70% em massa de amônia e cuja densidade é 0,9 g/L. A eficiência do processo foi de 65% e foram observadas as seguintes reações químicas e respectivas variações de entalpia (∆Hn, em que n = 1 ou 2):

Nessa situação hipotética, considerando-se que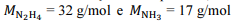 sejam as massas molares da hidrazina e da amônia, respectivamente, a variação de entalpia envolvida na quebra da amônia, caso o rendimento da reação tivesse sido de 100%, seria
sejam as massas molares da hidrazina e da amônia, respectivamente, a variação de entalpia envolvida na quebra da amônia, caso o rendimento da reação tivesse sido de 100%, seria
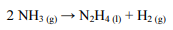
Essa reação ocorreu a partir de 0,07 m3 de uma mistura gasosa que possui 70% em massa de amônia e cuja densidade é 0,9 g/L. A eficiência do processo foi de 65% e foram observadas as seguintes reações químicas e respectivas variações de entalpia (∆Hn, em que n = 1 ou 2):

Nessa situação hipotética, considerando-se que
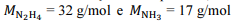 sejam as massas molares da hidrazina e da amônia, respectivamente, a variação de entalpia envolvida na quebra da amônia, caso o rendimento da reação tivesse sido de 100%, seria
sejam as massas molares da hidrazina e da amônia, respectivamente, a variação de entalpia envolvida na quebra da amônia, caso o rendimento da reação tivesse sido de 100%, seria