Questões da prova:
FGV - 2022 - SME-SP Secretaria Municipal de Educação de São Paulo - Professor - Química
limpar filtros
60 Questões de concurso encontradas
Página 5 de 12
Questões por página:
Questões por página:
Disciplina:
Química
Séries de desintegração radioativa são conjuntos de elementoscom núcleos instáveis, que seguem uma sequência ordenada dedesintegrações espontâneas.
A série do tório, por exemplo, inicia-se pela sequência:
• 232Th90 → 228Ra88 + α • 228Ra88 → AXZ + β • AXZ → 228Th90 + β
O produto da segunda equação química é um núcleo
A série do tório, por exemplo, inicia-se pela sequência:
• 232Th90 → 228Ra88 + α • 228Ra88 → AXZ + β • AXZ → 228Th90 + β
O produto da segunda equação química é um núcleo
Disciplina:
Química
A Cipermetrina é uma substância do grupo dos piretróides e possui classificação toxicológica nível II (altamente tóxica). É fotoestável, não se degradando com a luz solar. Atua como um potente inseticida, por contato ou ingestão, contra alvos biológicos que causam consideráveis danos a culturas como algodão, café, milho e soja.
A fórmula que representa a estrutura química da cipermetrina é mostrada a seguir.
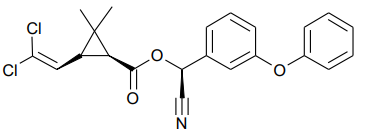
Nessa estrutura, é possível identificar os grupos funcionais
Disciplina:
Química
A energia de ionização (EI) é uma propriedade periódica quemostra tendência inversa ao raio atômico, diminuindo da direitapara a esquerda ao longo do período.
Entretanto, observa-se que, contrário à regra, os valores daprimeira energia de ionização dos átomos nitrogênio (Z = 7) eoxigênio (Z = 8) mostram EI(O) < EI(N):
• EI(N) = 1402 kJ mol-1 • EI(O) = 1314 kJ mol-1
Assinale a opção que justifica corretamente a relação entre osvalores de EI do nitrogênio e do oxigênio.
Entretanto, observa-se que, contrário à regra, os valores daprimeira energia de ionização dos átomos nitrogênio (Z = 7) eoxigênio (Z = 8) mostram EI(O) < EI(N):
• EI(N) = 1402 kJ mol-1 • EI(O) = 1314 kJ mol-1
Assinale a opção que justifica corretamente a relação entre osvalores de EI do nitrogênio e do oxigênio.
Disciplina:
Química
Bohr desenvolveu seu modelo atômico adotando duas premissas:
1. A quantização do momento angular.2. O equilíbrio mecânico atingido pela igualdade dos módulos das forças elétrica (de atração do elétron ao núcleo) e centrípeta (do movimento circular do elétron em torno do núcleo).
Dessa forma, ele desenvolveu uma expressão para a energia que depende de um número quântico, n, que indica o nível de energia eletrônica e determina o raio.
A esse respeito, assinale V para a afirmativa verdadeira e F para a falsa.
( ) O modelo atômico de Bohr permitiu descrever com sucesso o raio do movimento circular do elétron em torno do núcleo de hidrogênio no estado fundamental. ( ) O modelo atômico de Bohr permitiu descrever com sucesso a diferença de energia entre dois níveis eletrônicos do átomo de hidrogênio. ( ) O modelo atômico de Bohr permitiu descrever com sucesso o comprimento de onda associado a excitações eletrônicas em átomos de qualquer número atômico.
As afirmativas são, respectivamente,
1. A quantização do momento angular.2. O equilíbrio mecânico atingido pela igualdade dos módulos das forças elétrica (de atração do elétron ao núcleo) e centrípeta (do movimento circular do elétron em torno do núcleo).
Dessa forma, ele desenvolveu uma expressão para a energia que depende de um número quântico, n, que indica o nível de energia eletrônica e determina o raio.
A esse respeito, assinale V para a afirmativa verdadeira e F para a falsa.
( ) O modelo atômico de Bohr permitiu descrever com sucesso o raio do movimento circular do elétron em torno do núcleo de hidrogênio no estado fundamental. ( ) O modelo atômico de Bohr permitiu descrever com sucesso a diferença de energia entre dois níveis eletrônicos do átomo de hidrogênio. ( ) O modelo atômico de Bohr permitiu descrever com sucesso o comprimento de onda associado a excitações eletrônicas em átomos de qualquer número atômico.
As afirmativas são, respectivamente,
Disciplina:
Química
Ácido crotônico é um composto insaturado de cadeia normal. Ele é sólido, de ponto de fusão 71,6oC, e, em soluções aquosas, comporta-se como um ácido fraco, com Ka = 2x010–5.
A fórmula química que representa sua estrutura é apresentada abaixo:
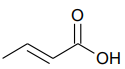
Uma solução aquosa de ácido crotônico foi preparada pela dissolução de 2,15g do ácido em água, sendo o volume final igual a 500mL.
[Dados: massas molares (em g.mol-1). C: 12; H: 1; O: 16.]
O pH dessa solução é igual a
A fórmula química que representa sua estrutura é apresentada abaixo:

Uma solução aquosa de ácido crotônico foi preparada pela dissolução de 2,15g do ácido em água, sendo o volume final igual a 500mL.
[Dados: massas molares (em g.mol-1). C: 12; H: 1; O: 16.]
O pH dessa solução é igual a