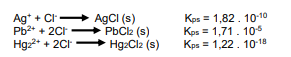Questões da prova:
INSTITUTO MAIS - 2023 - Prefeitura de Santos - Engenheiro Químico
limpar filtros
50 Questões de concurso encontradas
Página 4 de 10
Questões por página:
Questões por página:
Concurso:
Prefeitura de Santos
Disciplina:
Química
mostrar texto associado
O precipitado branco da questão anterior (que havia sido completamente precipitado com HCl diluído), foi recolhido após filtração, recebeu mais 10 ml de água destilada e foi aquecido em banho-maria até a temperatura de ebulição da água, mantido assim por cerca de 5 minutos. Esse processo de aquecimento dissolveu todo material que estava precipitado. Isso indicou que apenas um dos 3 cloretos estava presente no sal branco que havia precipitado, já que dois deles são tão insolúveis que não se redissolveriam com o aquecimento na solução aquosa, sem que ocorressem mudanças no pH da solução. Com base nas informações fornecidas, assinale a alternativa que apresenta qual dos 3 cátions estava presente na solução amostra: Ag+, Pb2+ ou Hg2 2+ .
Concurso:
Prefeitura de Santos
Disciplina:
Química
mostrar texto associado
Em uma solução amostra, dentro de um tubo de ensaio, gotejou-se uma solução diluída de HCl em quantidade suficiente para causar a precipitação completa de sais brancos no fundo do tubo. A partir desse teste, sobre a composição da solução amostra antes da precipitação, pode-se concluir que
Concurso:
Prefeitura de Santos
Disciplina:
Engenharia Química e Química Industrial
A pilha de Zinco/Óxido de Manganês pode ser representada pelas reações abaixo. A reação no ânodo será de formação de cloreto de zinco e liberação de um elétron:
Zn + 2 Cl− → ZnCl2 + 2 e−
A reação no cátodo produz hidróxido de zinco e óxido de manganês (3+):
2 MnO2 + ZnCl2 + H2O + 2 e− → Mn2O3 + Zn(OH)2 + 2 Cl−
A reação geral simplificada da pilha vai ser: Zn + 2 MnO2 + H2O → Mn2O3 + Zn(OH)2
Essas pilhas alcalinas fornecem um ddp de cerca de 1,5 volts, e como todas as pilhas, tendem a sofrer com a autodescarga e com reações de deterioração. Mesmo ficando sem uso, sua capacidade vai se degradando aos poucos, pois a placa de zinco na pilha vai sendo corroída com o tempo e ocorrem vazamentos que colocam os eletrólitos em contato. Esses processos de auto degradação são acelerados quando as pilhas são submetidas a temperaturas mais altas. Nesse tipo de pilha, cerca de 0,08% de sua capacidade é perdida a cada dia sob uma temperatura de 20 °C (ou seja, em 2 meses, sem usar a pilha, sua capacidade terá chegado a cerca de 94,5% do valor original). Essa degradação é fortemente acelerada, podendo chegar a 0,6% quando a temperatura ambiente é de 45 °C (em 2 meses, sem usar a pilha, sua capacidade terá chegado a cerca de 69,7% do valor original) reduzindo importantemente a vida útil da pilha. Assim, mesmo sem estarem em uso, pilhas AAA alcalinas têm uma capacidade de armazenamento inicial que vai caindo mais ou menos rapidamente, a partir dos valores iniciais de 1250 miliamp.hora ou 1.87 watts.hora. Por conta disso, os fabricantes de pilhas recomendavam guardá-las sob refrigeração enquanto não estivessem em uso, (sempre protegidas em sacos plásticos para não entrarem em contato com alimentos). O barateamento desse tipo de pilha no mundo fez mudar tais recomendações, mas seus princípios seguem válidos. Dessa maneira, a refrigeração faria as pilhas serem melhor preservadas em sua capacidade, até o momento do uso. Segundo a equação de Arrhenius:
K = A.e -Ea /RT
Onde:
K é a constante de velocidade de uma reação química; A é o chamado fator pré-exponencial; Ea é a Energia de ativação da reação; T é a Temperatura em °K .
Com base na equação acima, é correto afirmar que
Zn + 2 Cl− → ZnCl2 + 2 e−
A reação no cátodo produz hidróxido de zinco e óxido de manganês (3+):
2 MnO2 + ZnCl2 + H2O + 2 e− → Mn2O3 + Zn(OH)2 + 2 Cl−
A reação geral simplificada da pilha vai ser: Zn + 2 MnO2 + H2O → Mn2O3 + Zn(OH)2
Essas pilhas alcalinas fornecem um ddp de cerca de 1,5 volts, e como todas as pilhas, tendem a sofrer com a autodescarga e com reações de deterioração. Mesmo ficando sem uso, sua capacidade vai se degradando aos poucos, pois a placa de zinco na pilha vai sendo corroída com o tempo e ocorrem vazamentos que colocam os eletrólitos em contato. Esses processos de auto degradação são acelerados quando as pilhas são submetidas a temperaturas mais altas. Nesse tipo de pilha, cerca de 0,08% de sua capacidade é perdida a cada dia sob uma temperatura de 20 °C (ou seja, em 2 meses, sem usar a pilha, sua capacidade terá chegado a cerca de 94,5% do valor original). Essa degradação é fortemente acelerada, podendo chegar a 0,6% quando a temperatura ambiente é de 45 °C (em 2 meses, sem usar a pilha, sua capacidade terá chegado a cerca de 69,7% do valor original) reduzindo importantemente a vida útil da pilha. Assim, mesmo sem estarem em uso, pilhas AAA alcalinas têm uma capacidade de armazenamento inicial que vai caindo mais ou menos rapidamente, a partir dos valores iniciais de 1250 miliamp.hora ou 1.87 watts.hora. Por conta disso, os fabricantes de pilhas recomendavam guardá-las sob refrigeração enquanto não estivessem em uso, (sempre protegidas em sacos plásticos para não entrarem em contato com alimentos). O barateamento desse tipo de pilha no mundo fez mudar tais recomendações, mas seus princípios seguem válidos. Dessa maneira, a refrigeração faria as pilhas serem melhor preservadas em sua capacidade, até o momento do uso. Segundo a equação de Arrhenius:
K = A.e -Ea /RT
Onde:
K é a constante de velocidade de uma reação química; A é o chamado fator pré-exponencial; Ea é a Energia de ativação da reação; T é a Temperatura em °K .
Com base na equação acima, é correto afirmar que
Concurso:
Prefeitura de Santos
Disciplina:
Engenharia Química e Química Industrial
Sabe-se que os aparelhos de espectrofotometria leem sempre uma diferença entre a fonte de luz sem a amostra e a luz que a atravessa. Nesse comparativo, a grandeza física realmente mediada é a transmitância, não a absorbância. Na prática, utiliza-se mais os valores de absorbância. Felizmente, a conversão entre as duas grandezas exige apenas o seguinte cálculo matemático:
Absorbância = log (1/Transmitância)
Foram feitas duas leituras de Transmitância (T1 e T2), de amostras distintas. As absorbâncias, nesse caso, indicam a presença de um contaminante (chumbo) na solução. Quanto mais concentrada em íons chumbo (2+) na solução, mais intensa é sua absorbância.
Os valores encontrados para as leituras de transmitâncias, foram os listados abaixo.
T1 = 0,1 T2 = 1,0
Para expressar esses valores nas suas respectivas Absorbâncias (A1 e A2), assinale a alternativa que apresenta, respectivamente, os valores equivalentes e quais seriam as amostras contaminadas com sal de chumbo.
Absorbância = log (1/Transmitância)
Foram feitas duas leituras de Transmitância (T1 e T2), de amostras distintas. As absorbâncias, nesse caso, indicam a presença de um contaminante (chumbo) na solução. Quanto mais concentrada em íons chumbo (2+) na solução, mais intensa é sua absorbância.
Os valores encontrados para as leituras de transmitâncias, foram os listados abaixo.
T1 = 0,1 T2 = 1,0
Para expressar esses valores nas suas respectivas Absorbâncias (A1 e A2), assinale a alternativa que apresenta, respectivamente, os valores equivalentes e quais seriam as amostras contaminadas com sal de chumbo.
Concurso:
Prefeitura de Santos
Disciplina:
Engenharia Química e Química Industrial
A medida do pH é um controle importante para garantir a qualidade da água e permitir o funcionamento adequado das caldeiras e seus sistemas e tubulações. Portanto, se faz necessária a instalação de um sensor de pH no conjunto gerador de vapor. Com esse objetivo, é correto afirmar que o sensor de pH deve ser instalado