Questões da prova:
CESGRANRIO - 2010 - Petrobras - Técnico de Inspeção de Equipamentos e Instalações Júnior
limpar filtros
60 Questões de concurso encontradas
Página 8 de 12
Questões por página:
Questões por página:
Em uma célula eletrolítica, a corrente elétrica é fornecida por uma fonte externa e usada para forçar uma reação química não espontânea. Um dos processos industriais mais importantes é a eletrólise da salmoura (solução aquosa de NaCl), cujo esquema reacional é mostrado abaixo. Por meio desse processo, obtêm-se importantes produtos como o hidróxido de sódio e o cloro gasoso.
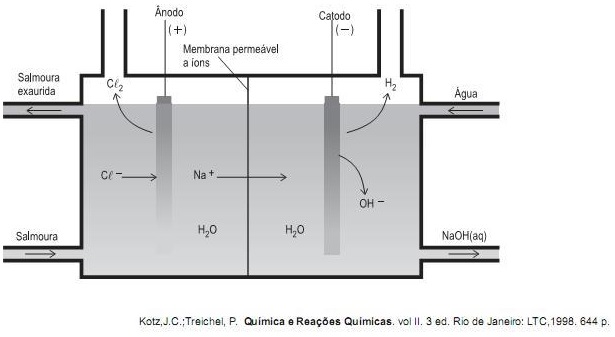
Com base nos conhecimentos sobre a eletrólise da salmoura, conclui-se que
Uma célula a combustível gera eletricidade diretamente de uma reação química, como em uma bateria, mas usa reagentes que são fornecidos continuamente, como em um motor. O desenvolvimento dessas células tem levado a um novo tipo de tecnologia, que utiliza reações redox de forma mais eficiente.
As reações químicas que ocorrem em uma célula a combustível alcalina são representadas a seguir.
As reações químicas que ocorrem em uma célula a combustível alcalina são representadas a seguir.
Ânodo: 2H2 (g) + 4OH− (aq) → 4H2O (l) + 4e−
Eletrólito: KOH (aq)
Catodo: O2 (g) + 4e− + 2H2O (l) 4OH− (aq)
Com base nesses dados sobre a célula a combustível alcalina, conclui-se que
Eletrólito: KOH (aq)
Catodo: O2 (g) + 4e− + 2H2O (l) 4OH− (aq)
Com base nesses dados sobre a célula a combustível alcalina, conclui-se que
Uma pilha consiste na transformação de energia química em energia elétrica, utilizando o fluxo de elétrons proveniente de uma reação de oxi-redução. A figura a seguir representa esquematicamente uma pilha, na qual um dos eletrodos é de zinco.
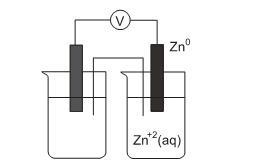

Para que essa pilha opere com a maior diferença de potencial possível (ΔEº), o outro eletrodo deverá ser o de
As reações redox, como são conhecidas, formam uma classe muito versátil de transformações químicas. Entre elas estão a combustão, a fotossíntese, a extração de metais a partir de minérios, dentre outras.
Considere a reação abaixo, onde íons permanganato reagem com ácido oxálico, em solução aquosa ácida, produzindo íons manganês II, dióxido de carbono e água.
Considere a reação abaixo, onde íons permanganato reagem com ácido oxálico, em solução aquosa ácida, produzindo íons manganês II, dióxido de carbono e água.
2MnO4– (aq) + 5H2C2O4(aq) + 6H+(aq) → 2Mn+2(aq) + 8H2O(l) + 10CO2(g)
A partir do processo descrito, conclui-se que
A partir do processo descrito, conclui-se que
Concurso:
Petrobras
Disciplina:
Química Industrial
Na indústria, é muito comum o armazenamento de soluções em tanques metálicos, armazenamento este que deve ser feito de forma cautelosa para que não haja contaminação da solução.
Armazenando-se, por exemplo, uma solução de nitrato de cobre II – Cu(NO3)2 – em um tanque revestido internamente por estanho metálico, observam-se a contaminação dessa solução por íons de estanho e a deposição de cobre metálico no fundo do tanque. Esse fato ocorre porque o(s)
Armazenando-se, por exemplo, uma solução de nitrato de cobre II – Cu(NO3)2 – em um tanque revestido internamente por estanho metálico, observam-se a contaminação dessa solução por íons de estanho e a deposição de cobre metálico no fundo do tanque. Esse fato ocorre porque o(s)