70 Questões de concurso encontradas
Página 8 de 14
Questões por página:
Em um experimento colocou-se SO2Cl2(g) em um recipiente lacrado, mantido a 400 K. Nesta temperatura, a constante de equilíbrio Kp para a reação de decomposição deste gás: SO2Cl2(g) - SO2(g) + Cl2(g) é 2,4 quando as pressões são medidas em atmosferas (atm). Determine a pressão parcial do gás cloro formado no equilíbrio a 400 K, se, neste experimento, a pressão do equilíbrio medida foi 3 atm.
A diferença de potencial obtida na pilha, representada pela figura abaixo, no início de sua operação é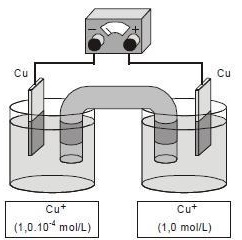
Os alcanos halogenados C3H7Br, C3H7Cl, C3H7I, CH3Cl, C2H5Cl, em ordem crescente de ponto de ebulição são:
Com base nas entalpias padrão (-H°) para as reações abaixo, determine a entalpia padrão para a reação de formação do etano a partir do carbono sólido e do gás hidrogênio.
1. C(s) + O2(g) → CO2(g) ΔH° = −393,5 kJ/mol
2. H2(g) + 1/2O2(g) → H2O(g) ΔH° = −285,8 kJ/mol
3. CH4(g) + 2O2(g) → CO2(g) + 2H2O(g) ΔH° = −890,3 kJ/mol
4. C2H6(g) + H2(g) → 2CH4(g) ΔH° = −65,9 kJ/mol