Questões da prova:
CEPERJ - 2015 - SEDUC-RJ - Professor - Química
limpar filtros
50 Questões de concurso encontradas
Página 4 de 10
Questões por página:
Questões por página:
Ernest Rutherford (1871-1937) foi quem descobriu que, se um núcleo radioativo se desintegra emitindo uma partícula α ou β, o núcleo resultante é, em regra, também radioativo e, mais cedo ou mais tarde, acaba expulsando alguma partícula para converter- se em outro núcleo, e assim por diante, até terminar num núcleo estável, isto é, não radioativo. Considere o nuclídeo urânio-238 que, após uma série de emissões, transforma-se no chumbo-206. A quantidade de partículas alfa e beta emitidas nesta série radioativa é, respectivamente, igual a:
Uma amostra de 0,265 g de um antibiótico em pó foi dissolvida em HCl e completou-se o volume até 100,00 mL de solução. Uma alíquota de 25,00 mL foi transferida para um balão, seguida da adição de 25,00 mL de solução aquosa 0,018 mol.L–1 de KBrO3. Um excesso de KBr foi adicionado para formar Br2, segundo a equação a seguir: BrO3– + 5Br – + 6H+ → 3Br2 + 3H2O
O bromo formado reage com toda a sulfanilamida presente no antibiótico e, após um tempo, é adicionado excesso de KI, para reagir com o excesso de bromo, formando I2. Finalmente, o iodo formado é titulado, consumindo 13,00 mL de uma solução aquosa 0,12 mol.L–1 de tiossulfato de sódio. As demais equações químicas são:
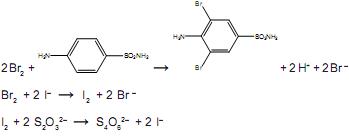
A porcentagem de sulfanilamida presente na amostra do antibiótico em pó é aproximadamente igual a:
Dado: Massa molar da sulfanilamida= 172 g. mol -1
A atividade biológica de compostos quirais pode variar muito de um enantiômero para outro. O caso mais célebre ocorreu com a talidomida, que causou defeitos congênitos (teratogênese) em fetos de grávidas que fizeram uso de medicamentos contendo misturas de seus isômeros ópticos, cujas estruturas estão indicadas a seguir:
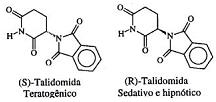
Considere um medicamento que continha um excesso enantiomérico de 50%, em relação ao isômero (R). Pode-se afirmar, então, que a composição percentual da mistura era igual a:
A possibilidade de estabelecimento de ligação entre dois átomos pode ser de?nida em termos de um parâmetro denominado ordem de ligação (O.L), que pode ser determinada a partir do número de elétrons em orbitais ligantes e antiligantes em diagramas de energia dos orbitais, usando-se a Teoria dos Orbitais Moleculares (TOM). Considerando o parâmetro acima citado, a associação correta entre a molécula e sua ordem de ligação está presente em:
O ácido benzoico tem entalpia padrão de combustão igual a -3227 kJ.mol -1 . Para calibrar um calorímetro, foram usados 2,27 g deste ácido, aumentando em 5,0°C a temperatura do calorímetro. Em seguida, com o calorímetro a 25°C, promoveu-se a queima de 1,6 g de acetileno (etino) e a temperatura subiu para 31,7°C. A entalpia padrão de combustão do acetileno, em kJ.mol -1 , é aproximadamente igual a:
Dados: Massas molares (g.mol -1 ), H= 1, C=12, O=16
Dados: Massas molares (g.mol -1 ), H= 1, C=12, O=16