Questões de Concurso
Filtrar
183 Questões de concurso encontradas
Página 15 de 37
Questões por página:
Questões por página:
Um químico preparou uma solução de Ba+2 comconcentração 0,025M. Inicia-se então umatitulação com 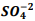 seguindo a reação: BαSO4(s) ⇔
seguindo a reação: BαSO4(s) ⇔ 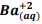 +
+ 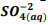 , onde Kps = [ Bα+2] [
, onde Kps = [ Bα+2] [ 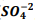 ] = 1,1 x10−10. Verifica-se que:
] = 1,1 x10−10. Verifica-se que:
I. A partir da concentração de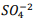 acima de0,025M inicia a precipitação de Ba+2. II. Em concentrações menores que 4,4 x10−9 M jáhouve precipitação de BαSO4.
acima de0,025M inicia a precipitação de Ba+2. II. Em concentrações menores que 4,4 x10−9 M jáhouve precipitação de BαSO4.
Assinale a alternativa correta:
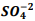 seguindo a reação: BαSO4(s) ⇔
seguindo a reação: BαSO4(s) ⇔ 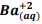 +
+ 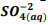 , onde Kps = [ Bα+2] [
, onde Kps = [ Bα+2] [ 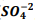 ] = 1,1 x10−10. Verifica-se que:
] = 1,1 x10−10. Verifica-se que: I. A partir da concentração de
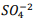 acima de0,025M inicia a precipitação de Ba+2. II. Em concentrações menores que 4,4 x10−9 M jáhouve precipitação de BαSO4.
acima de0,025M inicia a precipitação de Ba+2. II. Em concentrações menores que 4,4 x10−9 M jáhouve precipitação de BαSO4. Assinale a alternativa correta:
Considere a titulação de 100,0 ml do ácido acético 0,100M com hidróxido de sódio 0,100M:
CH3CO2H(aq) + OH-(aq) ⇔ CH3CO2-(aq) + H2O(l)
Para atingir o ponto de equivalência foram gastos 5,3 x10-6 M de OH- e o pH ficou em 8,72.
Analise as afirmativas a seguir e dê valores Verdadeiro (V) ou Falso (F).
( ) No ponto de equivalência o pH é neutro. ( ) No ponto de equivalência, o pH é ligeiramente básico, porém a partir desse ponto, a adição de mais NaOH torna a solução substancialmente básica.
Assinale a alternativa que apresenta a sequência correta de cima para baixo.
CH3CO2H(aq) + OH-(aq) ⇔ CH3CO2-(aq) + H2O(l)
Para atingir o ponto de equivalência foram gastos 5,3 x10-6 M de OH- e o pH ficou em 8,72.
Analise as afirmativas a seguir e dê valores Verdadeiro (V) ou Falso (F).
( ) No ponto de equivalência o pH é neutro. ( ) No ponto de equivalência, o pH é ligeiramente básico, porém a partir desse ponto, a adição de mais NaOH torna a solução substancialmente básica.
Assinale a alternativa que apresenta a sequência correta de cima para baixo.
O pH de uma solução-tampão de ácido acético e acetato de sódio é representada por CH3COOH + H2O ⇔ CH3COO- + H3O+ . A concentração inicial de CH3COOH = 0,700M e CH3COO- = 0,600M e a constante de equilíbrio é 1,8.10-5.
A equação que melhor representa a constante de equilíbrio para esse tampão é:
A equação que melhor representa a constante de equilíbrio para esse tampão é:
Cromatografia é uma técnica muito utilizada em laboratórios de pesquisas e analíticos com a intenção de analisar e quantificar substâncias orgânicas. Os analitos percorrem uma coluna preenchida com uma fase estacionária (que pode ser eletricamente neutra ou carregada e saem no outro orifício em tempos determinados. O que faz esse analito ficar mais ou menos tempo dentro das colunas é o quanto esse composto é adsorvido pelo material de preenchimento da coluna, ou seja, quanto menor o tempo, menor a interação com a coluna.
Um par de aminoácido é separado em uma coluna onde a fase estacionária está saturada com água e o solvente transportados é o metanol. Os aminoácidos são:
HOOC-CHNH2-CH2-OH e HOOC-CHNH2-CH3.
Assinale a alternativa que melhor representa o que acontece.
Um par de aminoácido é separado em uma coluna onde a fase estacionária está saturada com água e o solvente transportados é o metanol. Os aminoácidos são:
HOOC-CHNH2-CH2-OH e HOOC-CHNH2-CH3.
Assinale a alternativa que melhor representa o que acontece.
Analise a seguinte situação: Misturou-se, em um balão de 1 l,0,10 mol de H2,0,10 mol de I2. Calcule a concentração no equilíbrio de todas as espécies em temperatura constante. Reação H2(g) + I2(g) ⇔ 2HI, onde K = 64.
Assinale a alternativa que contenha a concentração no equilíbrio de H2(g), I2(g) e HI respectivamente:
Assinale a alternativa que contenha a concentração no equilíbrio de H2(g), I2(g) e HI respectivamente: