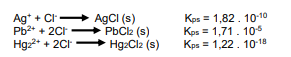Filtrar
180 Questões de concurso encontradas
Página 1 de 36
Questões por página:
Questões por página:
Assinale a opção que apresenta o pH de uma solução de um ácido monoprótico (Ka = 2,0 x 10-6 ) com concentração de 2,0 M. Dado: log10 2 ≈ 0,3.
Concurso:
SAE de Catalão - GO
Disciplina:
Química
O pH é um parâmetro importante a ser considerado no processo de tratamento de água e de efluentes. Na agricultura, o uso de cal hidratada (Ca(OH)2) no processo de calagem e de fertilizantes como o nitrato de amônio (NH4NO3), podem afetar o pH de água de rios.
Sobre a alteração no pH acarretada por cada uma das substâncias citadas, assinale a única alternativa correta.
Concurso:
Prefeitura de Pouso Alegre - MG
Disciplina:
Química
Analise as alternativas a seguir.
I. Copo com álcool hidratado.
II. Copo com água e gelo.
III. Copo de água com gás.
O sistema heterogêneo com duas fases é observado apenas em:
Concurso:
Prefeitura de Santos
Disciplina:
Química
mostrar texto associado
O precipitado branco da questão anterior (que havia sido completamente precipitado com HCl diluído), foi recolhido após filtração, recebeu mais 10 ml de água destilada e foi aquecido em banho-maria até a temperatura de ebulição da água, mantido assim por cerca de 5 minutos. Esse processo de aquecimento dissolveu todo material que estava precipitado. Isso indicou que apenas um dos 3 cloretos estava presente no sal branco que havia precipitado, já que dois deles são tão insolúveis que não se redissolveriam com o aquecimento na solução aquosa, sem que ocorressem mudanças no pH da solução. Com base nas informações fornecidas, assinale a alternativa que apresenta qual dos 3 cátions estava presente na solução amostra: Ag+, Pb2+ ou Hg2 2+ .
Concurso:
Prefeitura de Santos
Disciplina:
Química
mostrar texto associado
Em uma solução amostra, dentro de um tubo de ensaio, gotejou-se uma solução diluída de HCl em quantidade suficiente para causar a precipitação completa de sais brancos no fundo do tubo. A partir desse teste, sobre a composição da solução amostra antes da precipitação, pode-se concluir que