Questões de Concurso
Filtrar
224 Questões de concurso encontradas
Página 4 de 45
Questões por página:
Questões por página:
Boyle pesquisou experimentalmente o comportamento de gases mantidos a temperatura constante nas condições em que eles se comportam como gás ideal (pressões não muito altas e temperaturas não muito baixas).
Assim ele descobriu a lei que descreve, nessas condições, como a pressão de um gás mantido à temperatura constante varia em função do volume ocupado por ele.
Essa lei pode ser expressa, num diagrama p-V, pelo gráfico
Um gás ideal sofre uma expansão isotérmica entre dois estados de equilíbrio termodinâmico. Sejam Q a quantidade de calor cedida ou recebida pelo gás e W o trabalho realizado por ele ou sobre ele durante a expansão.
Essa quantidade de calor e esse trabalho são tais que
Essa quantidade de calor e esse trabalho são tais que
Disciplina:
Física
Uma certa quantidade de um gás ideal ocupa um volume de 200 L sob pressão de 2,0.105 Pa a 27°C.
Deseja-se elevar em 27°C a temperatura desse gás. Numa primeira tentativa aqueceu-se o gás a volume constante. Nesse caso, para obter a elevação de temperatura desejada, foi necessário fornecer-lhe uma quantidade de calor Q1.
Numa segunda tentativa aqueceu-se o gás a pressão constante. Nesse caso, para obter a mesma elevação de temperatura foi necessário fornecer-lhe uma quantidade de calor Q2.
A diferença Q2 – Q1 foi
Deseja-se elevar em 27°C a temperatura desse gás. Numa primeira tentativa aqueceu-se o gás a volume constante. Nesse caso, para obter a elevação de temperatura desejada, foi necessário fornecer-lhe uma quantidade de calor Q1.
Numa segunda tentativa aqueceu-se o gás a pressão constante. Nesse caso, para obter a mesma elevação de temperatura foi necessário fornecer-lhe uma quantidade de calor Q2.
A diferença Q2 – Q1 foi
Disciplina:
Física
Uma barra de ferro está em contato, numa extremidade, com gelo em fusão, e na outra, com vapor de água em ebulição, sob pressão atmosférica.
O comprimento da barra é 50 cm e sua seção transversal tem 10 cm2 de área.
O coeficiente de condutibilidade térmica do ferro é de 0,16 cal/s.cm.°C; o calor latente de fusão do gelo é de 80 cal/g e, o módulo do calor latente de condensação do vapor,540 cal/g. Considere o sistema isolado.
A massa do gelo que se funde, após 50 minutos, é
O comprimento da barra é 50 cm e sua seção transversal tem 10 cm2 de área.
O coeficiente de condutibilidade térmica do ferro é de 0,16 cal/s.cm.°C; o calor latente de fusão do gelo é de 80 cal/g e, o módulo do calor latente de condensação do vapor,540 cal/g. Considere o sistema isolado.
A massa do gelo que se funde, após 50 minutos, é
Disciplina:
Física
Um calorímetro de capacidade térmica desprezível contém gelo a – 20°C. Nele é injetado vapor d`água a 100°C.
A figura a seguir representa, em gráfico cartesiano, como suas temperaturas variam em função das quantidades de calor (em módulo) que um cede e, o outro, recebe.
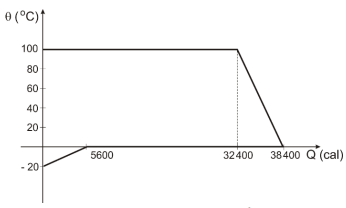
O calor específico da água (líquida) é 1,0 cal/g°C e o calor latente de fusão do gelo é de 80 cal/g.
Ao ser atingido o equilíbrio térmico, a massa de água na fase líquida contida no calorímetro é
A figura a seguir representa, em gráfico cartesiano, como suas temperaturas variam em função das quantidades de calor (em módulo) que um cede e, o outro, recebe.

O calor específico da água (líquida) é 1,0 cal/g°C e o calor latente de fusão do gelo é de 80 cal/g.
Ao ser atingido o equilíbrio térmico, a massa de água na fase líquida contida no calorímetro é