Questões de Concurso
Filtrar
236 Questões de concurso encontradas
Página 20 de 48
Questões por página:
Questões por página:
mostrar texto associado
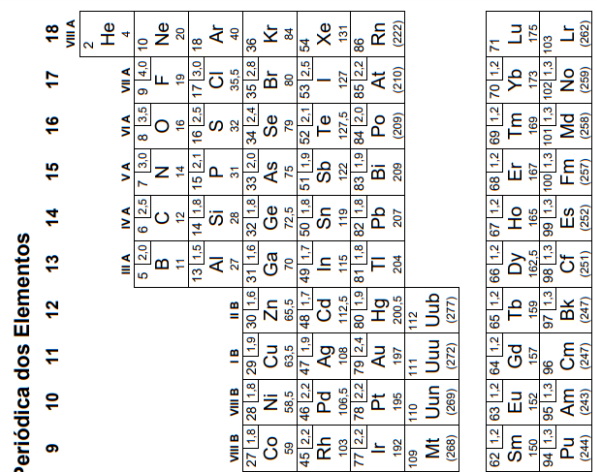
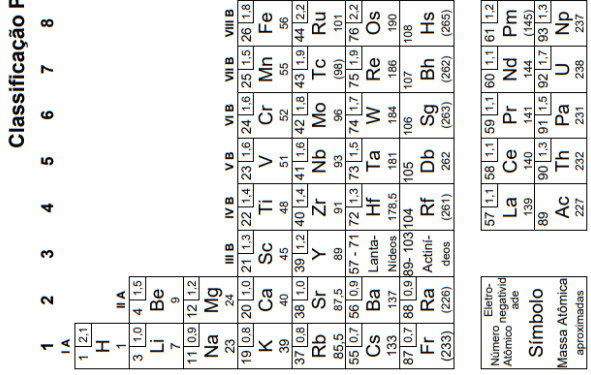
Tanto as equações químicas quanto as fórmulas dos diferentes compostos apresentam um significado quantitativo. A análise elementar de um composto químico de fórmula X2O revelou que em 2,9 g dessa substância pura há 2,7 g do elemento X.
O elemento X é o
O elemento X é o
mostrar texto associado
O ácido nítrico (HNO3) é uma importante matéria-prima na indústria química. Sua produção comercial ocorre através da conversão da amônia (NH3) em uma sequência de três etapas denominada Processo de Ostwald. Na primeira etapa, ocorre a oxidação catalítica da amônia:
4NH3(g) + 5O2(g) → 4NO(g) + 6H2O(g)
Na segunda etapa, o óxido nítrico (NO) formado, quando exposto ao ar, se oxida rapidamente dando origem ao dióxido de nitrogênio (NO2):
2NO(g) + O2 → 2NO2(g)
Na terceira etapa, o NO2, quando dissolvido em água, forma o ácido nítrico como descrito na reação a seguir:
3NO2(g) + H2O(l) → 2HNO3(aq) + NO(g)
A quantidade máxima de ácido nítrico, em kg, que pode ser obtida a partir de 10.000 L de amônia é igual a
(Dado: volume molar = 25,0 L.mol-1)
4NH3(g) + 5O2(g) → 4NO(g) + 6H2O(g)
Na segunda etapa, o óxido nítrico (NO) formado, quando exposto ao ar, se oxida rapidamente dando origem ao dióxido de nitrogênio (NO2):
2NO(g) + O2 → 2NO2(g)
Na terceira etapa, o NO2, quando dissolvido em água, forma o ácido nítrico como descrito na reação a seguir:
3NO2(g) + H2O(l) → 2HNO3(aq) + NO(g)
A quantidade máxima de ácido nítrico, em kg, que pode ser obtida a partir de 10.000 L de amônia é igual a
(Dado: volume molar = 25,0 L.mol-1)
Recentemente, um britânico de 23 anos de idade morreu por overdose de cafeína (C8H10N4O2). Na necropsia, foi constatado que havia o equivalente a 70 latas de energético em seu organismo, sendo a dose de cafeína em cada lata equivalente a 30 mg.
Com base nessa situação e considerando-se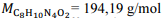 a massa molar da cafeína e
a massa molar da cafeína e 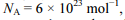 a constante de Avogadro, é correto concluir que o número de moléculas de cafeína ingeridas pelo britânico é
a constante de Avogadro, é correto concluir que o número de moléculas de cafeína ingeridas pelo britânico é
Com base nessa situação e considerando-se
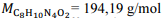 a massa molar da cafeína e
a massa molar da cafeína e 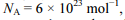 a constante de Avogadro, é correto concluir que o número de moléculas de cafeína ingeridas pelo britânico é
a constante de Avogadro, é correto concluir que o número de moléculas de cafeína ingeridas pelo britânico é Apesar de ser conhecida a mais de 12 séculos, ainda atualmente a pólvora tem grande aplicação por seu efeito explosivo, em especial na indústria de armamentos. A pólvora é uma mistura de salitre (KNO3), carvão (c) e enxofre (S), com percentuais em massa de 75%,15% e 10%, respectivamente. Sob calor ou pressão, a seguinte reação ocorre com a pólvora:
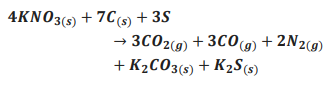
A expansão dos gases gerados nessa reação causa o efeito explosivo da pólvora. Considere uma munição com 10,10 g de pólvora reagindo de acordo com a equação acima, porém com somente 60% do salitre presente sofrendo essa reação. Assinale a alternativa que apresenta a quantidade de mols de gases gerados no disparo dessa munição?
MM (K=39 g/mol; N=14 g/mol; O=16 g/mol; C=12 g/mol; S=32 g/mol)
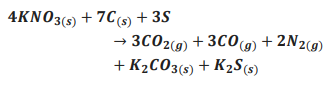
A expansão dos gases gerados nessa reação causa o efeito explosivo da pólvora. Considere uma munição com 10,10 g de pólvora reagindo de acordo com a equação acima, porém com somente 60% do salitre presente sofrendo essa reação. Assinale a alternativa que apresenta a quantidade de mols de gases gerados no disparo dessa munição?
MM (K=39 g/mol; N=14 g/mol; O=16 g/mol; C=12 g/mol; S=32 g/mol)
Uma mistura de carbonato de sódio decahidratado e bicarbonato de sódio foi colocada em um cadinho e levada a uma mufla a 350 °C por 3 h, tendo ocorrido as seguintes reações.
Na2CO3 · 10 H2O(s) → Na2CO3(s) + 10 H2O(v)
2 NaHCO3(s) → Na2CO3(s) + H2O(v) + CO2(g)
Finalizado o processo, restou unicamente carbonato de sódio no cadinho, verificando-se uma perda total de massa de 6,70 g.
Sabendo que M(H) = 1 g/mol, M(C) = 12 g/mol, M(O) = 16 g/mol e M(Na) = 23 g/mol, e supondo que a quantidade de CO2 seco desprendido do cadinho seja igual a 2,20 g, assinale a opção que indica a quantidade, em gramas, de Na2CO3 · 10 H2O existente na mistura inicial.