Questões de Concurso
Filtrar
202 Questões de concurso encontradas
Página 7 de 41
Questões por página:
O minério chamado “blenda” é utilizado na obtenção de zinco. Sabendo-se que uma amostra de tal minério contém 90% de pureza, a massa, em gramas, de zinco que pode ser obtida a partir de 200g de blenda é de:
Dados: Zn=65 e S=32.
O clorato de potássio é obtido pela passagem de cloro em uma solução de hidróxido de sódio, produzindo-se também cloreto de potássio e água. Uma solução assim obtida foi evaporada à secura e aquecida para a decomposição do clorato. Sabendo-se que o resíduo total do cloreto de potássio pesou 298g, a massa, em gramas, do hidróxido de potássio utilizada é de:
Dados: K=39; Cl=35,5; O=16; H=1.
A calcinação de 1,0 mol de sulfato de amônio formará quatro substâncias, sendo uma delas o gás amônia. A massa de gás amônia, em gramas, produzida na referida reação será de:
Dados: Ca=40; S=32; O=16 e H=1.
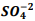 seguindo a reação: BαSO4(s) ⇔
seguindo a reação: BαSO4(s) ⇔ 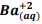 +
+ 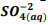 , onde Kps = [ Bα+2] [
, onde Kps = [ Bα+2] [ 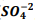 ] = 1,1 x10−10. Verifica-se que:
] = 1,1 x10−10. Verifica-se que: I. A partir da concentração de
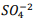 acima de0,025M inicia a precipitação de Ba+2. II. Em concentrações menores que 4,4 x10−9 M jáhouve precipitação de BαSO4.
acima de0,025M inicia a precipitação de Ba+2. II. Em concentrações menores que 4,4 x10−9 M jáhouve precipitação de BαSO4. Assinale a alternativa correta: