Filtrar
120 Questões de concurso encontradas
Página 1 de 24
Questões por página:
Questões por página:
Concurso:
Prefeitura de Santos
Disciplina:
Química
O uso de cromatografia para separar e identificar substâncias em uma mistura, é uma das técnicas experimentais mais versáteis da Química. Diversas são as técnicas: cromatografia gasosa, cromatografia de fase líquida, cromatografia de troca iônica, cromatografia por afinidade etc. Se hoje se usam colunas de cromatografia líquida super sofisticadas e de longos comprimentos, toda essa técnica nasceu da cromatografia de fase delgada e da cromatografia em papel. Mas os princípios básicos são sempre os mesmos. Trata-se de uma corrida entre moléculas que se deseja separar, identificar ou medir a concentração na mistura. Existe uma fase móvel, formada pelas moléculas sendo comparadas e um fluido carreador, que viaja através da fase estática. Essa fase estática, por sua vez, representa desafios diferenciados por afinidade ou por diferença com cada uma das moléculas que competem entre si. A medida que cada molécula termina o percurso estacionário, nessa corrida com obstáculos, seu tempo de prova pode ser registrado, que passará a identificá-la nas condições utilizadas. Instrumentos analíticos como espectrofotômetros de chama ou espectrômetros de massa etc. podem ser usados para corroborar as identificações dessas moléculas. Ao final da corrida, plota-se um gráfico característico.
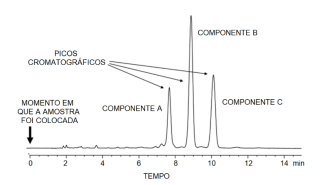
Considerando as informações do gráfico de HPLC (sigla em inglês de uma técnica cromatográfica, que se traduz como Cromatografia Líquida de Alta Performance), é correto afirmar que

Considerando as informações do gráfico de HPLC (sigla em inglês de uma técnica cromatográfica, que se traduz como Cromatografia Líquida de Alta Performance), é correto afirmar que