Questões de Concurso
Filtrar
210 Questões de concurso encontradas
Página 17 de 42
Questões por página:
Questões por página:
A reação de decomposição da amônia (NH3) pode produzir hidrazina (N2H4) e gás hidrogênio (H2), conforme a equação química que se segue.
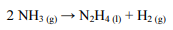
Essa reação ocorreu a partir de 0,07 m3 de uma mistura gasosa que possui 70% em massa de amônia e cuja densidade é 0,9 g/L. A eficiência do processo foi de 65% e foram observadas as seguintes reações químicas e respectivas variações de entalpia (∆Hn, em que n = 1 ou 2):

Nessa situação hipotética, considerando-se que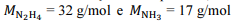 sejam as massas molares da hidrazina e da amônia, respectivamente, a variação de entalpia envolvida na quebra da amônia, caso o rendimento da reação tivesse sido de 100%, seria
sejam as massas molares da hidrazina e da amônia, respectivamente, a variação de entalpia envolvida na quebra da amônia, caso o rendimento da reação tivesse sido de 100%, seria
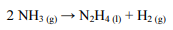
Essa reação ocorreu a partir de 0,07 m3 de uma mistura gasosa que possui 70% em massa de amônia e cuja densidade é 0,9 g/L. A eficiência do processo foi de 65% e foram observadas as seguintes reações químicas e respectivas variações de entalpia (∆Hn, em que n = 1 ou 2):

Nessa situação hipotética, considerando-se que
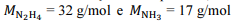 sejam as massas molares da hidrazina e da amônia, respectivamente, a variação de entalpia envolvida na quebra da amônia, caso o rendimento da reação tivesse sido de 100%, seria
sejam as massas molares da hidrazina e da amônia, respectivamente, a variação de entalpia envolvida na quebra da amônia, caso o rendimento da reação tivesse sido de 100%, seria No acidente com césio-137, ocorrido em setembro de 1987 em Goiânia, o material radioativo foi encontrado em um aparelho de radioterapia abandonado e logo depois vendido em um ferro-velho. A amostra de cloreto de césio foi capaz de contaminar muitas pessoas e causou algumas mortes na cidade.
O decaimento radioativo do césio está representando no gráfico a seguir.
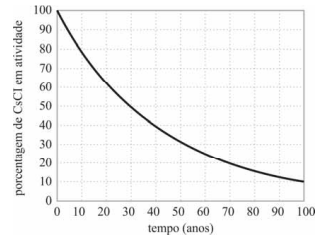
Considerando-se essas informações e sabendo-se que essa amostra radioativa deve ficar isolada por pelo menos 270 anos para que a massa restante (0,037 g) não represente um grande risco para a população, é correto inferir que a massa inicial da amostra contida no equipamento era
O decaimento radioativo do césio está representando no gráfico a seguir.

Considerando-se essas informações e sabendo-se que essa amostra radioativa deve ficar isolada por pelo menos 270 anos para que a massa restante (0,037 g) não represente um grande risco para a população, é correto inferir que a massa inicial da amostra contida no equipamento era
O ferro metálico, amplamente utilizado na indústria, pode ser obtido a partir da redução do óxido ferroso (FeO) pelo monóxido de carbono (CO), de acordo com a equação abaixo, cuja variação de entalpia é desconhecida.
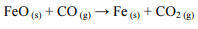
Caso essa reação seja realizada em etapas, as reações de cada etapa serão as seguintes, em que ∆Hn (n = 1,2 ou 3) representa a variação de entalpia da n-ésima etapa:
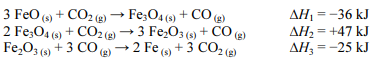
A partir da Lei de Hess, é possível calcular a variação de entalpia envolvida na primeira reação.
Nessa situação, considerando-se que MFe = 56 g/mol seja a massa molar do ferro, é correto concluir que a variação de entalpia envolvida na formação de 140 g de ferro metálico por meio da redução do óxido ferroso pelo monóxido de carbono é
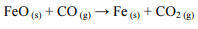
Caso essa reação seja realizada em etapas, as reações de cada etapa serão as seguintes, em que ∆Hn (n = 1,2 ou 3) representa a variação de entalpia da n-ésima etapa:
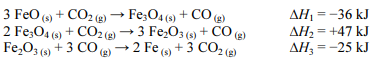
A partir da Lei de Hess, é possível calcular a variação de entalpia envolvida na primeira reação.
Nessa situação, considerando-se que MFe = 56 g/mol seja a massa molar do ferro, é correto concluir que a variação de entalpia envolvida na formação de 140 g de ferro metálico por meio da redução do óxido ferroso pelo monóxido de carbono é
Os processos físico-químicos são comumente utilizados na indústria química, farmacêutica e metalúrgica, bem como na mineração e na indústria solar. Dessa forma, tem-se que o processo físico-químico é todo fenômeno que ocorre sem que haja a formação de novas substâncias. Entalpia ou conteúdo de calor é a energia armazenada nas substâncias (reagentes ou produtos). Portanto, o calor trocado à pressão constante durante o processo é dado por: Q = H –H0→ Q = ∆H, sendo ∆H a variação de entalpia durante o processo. Como a maioria das reações acontece em recipientes abertos (pressão constante), a tendência é raciocinar em termos de ∆H. É possível afirmar que em uma reação exotérmica:
Em meados do século XX, as pilhas alcalinas surgiram como uma alternativa muito mais eficiente energeticamente em comparação às pilhas tradicionais. Como mostra a seguinte figura, a pilha alcalina utiliza os mesmos eletrodos da tradicional, porém o seu eletrólito é uma solução aquosa de hidróxido de sódio concentrada (~30% em massa) contendo uma dada quantidade de óxido de zinco ― daí a denominação alcalina para essa pilha.
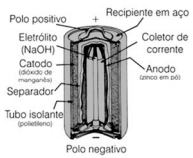
Internet:<http://qnesc.sbq.org.br> (com adaptações).