Questões de Concurso
Filtrar
356 Questões de concurso encontradas
Página 2 de 72
Questões por página:
Questões por página:
Disciplina:
Química
Usa-se hidróxido de cálcio, também conhecido como cal hidratada, no tratamento de águas, para eliminar a dureza temporária da água. Considere a reação química não balanceada abaixo:
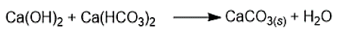
Considere as massas molares em g/mol: H= 1 g/mol, O= 16 g/mol e Ca= 40 g/mol. A massa de cal hidratada necessária para a obtenção de 350 mg de carbonato de cálcio é de
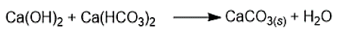
Considere as massas molares em g/mol: H= 1 g/mol, O= 16 g/mol e Ca= 40 g/mol. A massa de cal hidratada necessária para a obtenção de 350 mg de carbonato de cálcio é de
Disciplina:
Química
Durante uma aula de laboratório, um estudante derramou, sobre a bancada,25 mL de uma solução de ácido sulfúrico 2,0 mol/L. Para evitar acidentes, a solução de ácido sulfúrico foi neutralizada com carbonato de cálcio antes de a bancada ser limpa. Considere as seguintes massas molares: H= 1 g/mol, C= 12 g/mol, O= 16 g/mol e Ca= 40 g/mol.

A massa de carbonato de cálcio usada na neutralização foi de

A massa de carbonato de cálcio usada na neutralização foi de
Disciplina:
Química
Os alunos realizaram a síntese da sulfanilamida (MM= 172 g/mol), um antimicrobiano, a partir de 2 g de acetanilida, conforme reação de substituição aromática eletrofílica a seguir:
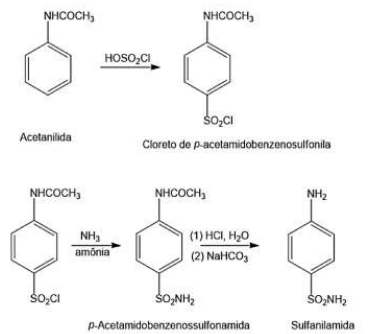
O rendimento da reação foi de 20%. Considere as seguintes massas molares: H= 1 g/mol, C= 12 g/mol, N= 14 g/mol, O= 16 g/mol e S= 32 g/mol. A massa de antimicrobiano, obtida ao final da reação, foi de

O rendimento da reação foi de 20%. Considere as seguintes massas molares: H= 1 g/mol, C= 12 g/mol, N= 14 g/mol, O= 16 g/mol e S= 32 g/mol. A massa de antimicrobiano, obtida ao final da reação, foi de
Concurso:
Prefeitura de Agudo - RS
Disciplina:
Química
Durante uma atividade experimental, um professor de Ciências pede que os alunos analisem o que ocorre nas situações abaixo:
• O açúcar (C₁₂H₂₂O₁₁) é aquecido em um béquer, escurece e se transforma em carvão.
• Um pedaço de metal de magnésio é colocado em ácido clorídrico, liberando gás hidrogênio.
Com base nas ligações químicas envolvidas e nos processos observados, qual análise é correta para orientar os alunos sobre as transformações químicas?
• O açúcar (C₁₂H₂₂O₁₁) é aquecido em um béquer, escurece e se transforma em carvão.
• Um pedaço de metal de magnésio é colocado em ácido clorídrico, liberando gás hidrogênio.
Com base nas ligações químicas envolvidas e nos processos observados, qual análise é correta para orientar os alunos sobre as transformações químicas?
Concurso:
Prefeitura de Chapecó - SC
Disciplina:
Química
Analise a transformação química abaixo:
N2 + 3 H2 → 2 NH3
Assinale a alternativa correta sobre o tipo de transformação química mostrado.
N2 + 3 H2 → 2 NH3
Assinale a alternativa correta sobre o tipo de transformação química mostrado.