Questões de Concurso
Filtrar
356 Questões de concurso encontradas
Página 57 de 72
Questões por página:
Mesmo que um modelo atômico consiga explicar muitos fenômenos ele não explica tudo o que acontece, e pode ser substituído. Em se tratando de modelos atômicos analise as proposições abaixo:
I. O modelo de Dalton foi um resgate da primitiva teoria atômica de Epicuro que viveu entre 341 a.C. e 270 a.C.
II. Rutherford postulou que o átomo era uma esfera maciça de carga positiva com cargas negativas incrustadas na superfície.
III. O modelo de Bohr repousava na mecânica clássica e explicava perfeitamente a existência de órbitas estacionárias.
IV. O modelo atual foi concebido com as contribuições de De Broglie, Heisenberg e Schrödinger.
V. O número quântico spin foi introduzido por Wolfgang Pauli para explicar a descoberta da duplicação das raias espectrais.
Está correto o que se afirma somente em
Atente para o que se afirma a seguir sobre as propriedades periódicas dos elementos químicos:
I. Considerando o segundo período da tabela periódica, é correto afirmar que quanto maior a atração entre núcleo e eletrosfera, menor é o raio atômico.
II. Energia de ionização é igual à energia mínima necessária para “arrancar” um elétron de um átomo isolado em estado gasoso.
III. Em um mesmo período da tabela periódica, como os raios diminuem à medida que se aproximam dos gases nobres, a energia de ionização tende a diminuir nesse mesmo sentido.
IV. Conforme nos deslocamos para baixo da tabela periódica, o raio atômico cresce num mesmo grupo. Os elétrons de valência ficam menos atraídos e a energia de ionização cai.
É correto o que se afirma em
Preencha as lacunas do seguinte quadro, supondo que cada coluna representa um átomo neutro:
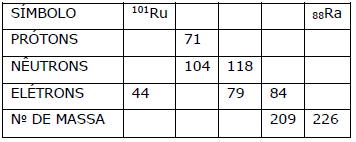
Considerando o quadro acima, assinale a afirmação FALSA.