Questões de Concurso
Filtrar
100 Questões de concurso encontradas
Página 1 de 20
Questões por página:
Questões por página:
Concurso:
Prefeitura de Santos
Disciplina:
Engenharia Química e Química Industrial
O gesso é um material aglomerante, obtido a partir da Gipsita, mineral abundante em terrenos cretáceos no Brasil, como o polo gesseiro do Araripe, estado de Pernambuco. Seu principal componente é o Sulfato de Cálcio di-hidratado. Por meio de calcinação, parte da água de hidratação é retirada e o mineral é moído para formar um pó, usado na construção civil e na medicina, entre muitas outras aplicações. Quando se reidrata o Sulfato de Cálcio hemi-hidratado, com cerca de um terço de seu peso em água, ele volta ao seu estado di-hidratado. Nesse processo, o gesso endurece em alguns minutos, em uma reação perceptivelmente exotérmica, vista abaixo:
CaSO4 . ½ H2O (s) + 3/2 H2O (liq) ➞ CaSO4 .2 H2O (s) + Energia (Calor)
Analisando a variação de entalpia dessa reação:

Um paciente, que teve a perna engessada para imobilização ortopédica, se queixou que o gesso esquentou muito enquanto endurecia. Pode-se estimar a temperatura máxima da peça de gesso assim que se endurece, com base nos dados de entalpia da reação acima, fazendo as seguintes considerações:
- A temperatura ambiente na sala ortopédica ficou estável em 21 °C, não se alterando enquanto o gesso foi aplicado e endureceu;
- A pressão não variou ao longo do processo de endurecimento do gesso e os valores de entalpia de cada substância não são dependentes da temperatura;
- Todo o calor liberado pela reação seria expresso no aumento de temperatura da peça de gesso
([ΔHoReação] = ΔHoAquecimento do Gesso).
Assim, calculando com base na equação de Kirchhoff:
n . [ΔHoReação] = n . Cp . ΔT
Onde:
n = Número de moles Cp = Capacidade Calorífica do Gesso = 186,2 Joules.K-1.mol-1 ΔT = Variação da Temperatura da peça de Gesso (Temperatura final ºK – Temperatura Inicial do Gesso ºK)
Dada a equação de conversão entre °K (kelvin) em °C (celsius):
°C = °K - 273,15
Depois de aplicar o cálculo, considerando que toda a energia térmica da reação fosse acumulada no gesso, com relação à temperatura do gesso, é correto afirmar que
CaSO4 . ½ H2O (s) + 3/2 H2O (liq) ➞ CaSO4 .2 H2O (s) + Energia (Calor)
Analisando a variação de entalpia dessa reação:

Um paciente, que teve a perna engessada para imobilização ortopédica, se queixou que o gesso esquentou muito enquanto endurecia. Pode-se estimar a temperatura máxima da peça de gesso assim que se endurece, com base nos dados de entalpia da reação acima, fazendo as seguintes considerações:
- A temperatura ambiente na sala ortopédica ficou estável em 21 °C, não se alterando enquanto o gesso foi aplicado e endureceu;
- A pressão não variou ao longo do processo de endurecimento do gesso e os valores de entalpia de cada substância não são dependentes da temperatura;
- Todo o calor liberado pela reação seria expresso no aumento de temperatura da peça de gesso
([ΔHoReação] = ΔHoAquecimento do Gesso).
Assim, calculando com base na equação de Kirchhoff:
n . [ΔHoReação] = n . Cp . ΔT
Onde:
n = Número de moles Cp = Capacidade Calorífica do Gesso = 186,2 Joules.K-1.mol-1 ΔT = Variação da Temperatura da peça de Gesso (Temperatura final ºK – Temperatura Inicial do Gesso ºK)
Dada a equação de conversão entre °K (kelvin) em °C (celsius):
°C = °K - 273,15
Depois de aplicar o cálculo, considerando que toda a energia térmica da reação fosse acumulada no gesso, com relação à temperatura do gesso, é correto afirmar que
Concurso:
Prefeitura de Santos
Disciplina:
Meio Ambiente
mostrar texto associado
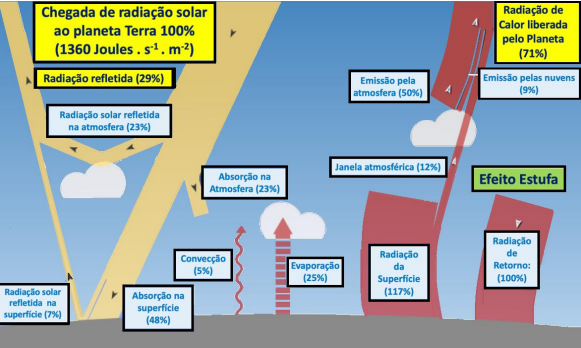
Ao analisar o diagrama, pode-se perceber que o efeito estufa, causado pelos gases da atmosfera, é fundamental para manter a temperatura dentro de valores capazes de sustentar as inúmeras formas de vida que se encontram em nosso planeta. Sem o efeito estufa, a temperatura média da Terra poderia ser 20 °C ou 30 °C mais baixa. Tal efeito acontece porque existe uma janela de transparência no espectro de absorção da mistura de gases da atmosfera que, por sua vez, permite a passagem da radiação eletromagnética UV/Visível. Uma vez incidindo sobre a superfície do planeta, essa energia será absorvida, usada em processos ligados à vida e retornada ao meio na forma de calor (radiação eletromagnética infravermelha). Acontece que essa radiação é reabsorvida pela própria atmosfera terrestre e só uma parte dela é devolvida ao espaço. O processo guarda parte do calor pela diferença de tempo entre a absorção e a liberação do calor, apesar de que o fluxo de energia eletromagnética vinda do Sol e devolvida ao espaço está em relativo equilíbrio. Esse equilíbrio nos mantém nessa média de temperaturas, adequadas à vida na Terra, por milênios sem grandes variações. Sobre o assunto, é correto afirmar que o efeito estufa
Concurso:
Prefeitura de Santos
Disciplina:
Física
mostrar texto associado
De acordo com medidas e cálculos desenvolvidos pela NASA em 2009, com base nos dados de satélites do projeto CERES, cerca de 1360 J s-1m-2 de energia solar chegam à alta atmosfera do planeta Terra. Esse é o mesmo valor de energia que o planeta retorna ao espaço, somando-se a reflexão de parte dessa radiação eletromagnética com o calor emitido pelo planeta de volta ao espaço. A radiação que chega é composta principalmente de frequências das bandas UV / Visível / Infravermelho Próximo e o calor irradiado desde a própria atmosfera e da superfície terrestre é composto maiormente pelos comprimentos de onda eletromagnéticos das bandas Infravermelho próximo e distante.
Pode-se dizer, então, que o fluxo de energia eletromagnética que chega na Terra vindo do Sol, é completamente balanceado pelo fluxo de energia eletromagnética que deixa o planeta na forma de calor. Em outras palavras, a Terra está em equilíbrio radiante, o que torna a temperatura relativamente estável ao longo de milênios. Assim, é correto afirmar que o sol fornece
Pode-se dizer, então, que o fluxo de energia eletromagnética que chega na Terra vindo do Sol, é completamente balanceado pelo fluxo de energia eletromagnética que deixa o planeta na forma de calor. Em outras palavras, a Terra está em equilíbrio radiante, o que torna a temperatura relativamente estável ao longo de milênios. Assim, é correto afirmar que o sol fornece
Concurso:
Prefeitura de Santos
Disciplina:
Engenharia Química e Química Industrial
A queima de combustíveis à base de Carbono, na presença de Oxigênio atmosférico, foi talvez a primeira tecnologia da engenharia química desenvolvida pelo ser humano. Quando dominamos o fogo, milênios antes de entendermos os princípios científicos envolvidos, aprendemos a reproduzir comportamentos empíricos e a contornar as dificuldades que apareciam, nos forçando a ser uma espécie cada vez mais criativa. Seguramente não foram poucos os dias de vento e chuva, onde os ancestrais humanos tiveram de usar musgo, cera das cascas de frutas e óleo de folhas de coníferas para aproveitar as chispas do novo conhecimento. Muito tempo se passou, a chama do conhecimento cresceu ainda mais e a humanidade decidiu explorar o espaço. Novamente, se deparou com dificuldades impensadas até então. Agora precisamos queimar metais (para obter maiores quantidades de energia) e levantar foguetes até superar a atmosfera terrestre. Exatamente lá onde não temos o oxigênio nos esperando com nossa fagulha de atrevimento. Mas encontramos soluções, como sempre fazemos.
Os poderosos combustíveis sólidos foram adotados inicialmente pela NASA em seus lançamentos e agora também sendo usados pelas agências privadas que prestam serviços aos governos, levando carga e passageiros para suas missões fora do planeta. As reações a seguir, representam as duas principais reações de oxirredução envolvidas na queima dos combustíveis sólidos dos foguetes:
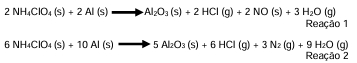
Analisando ambas as reações combinadas, fica evidente que o alumínio passa do estado de oxidação (zero) para (3+), enquanto o cloro passa de (+7) para (-1). Assim, pode-se concluir nessa análise que o estado de oxidação de nitrogênio vai de
Os poderosos combustíveis sólidos foram adotados inicialmente pela NASA em seus lançamentos e agora também sendo usados pelas agências privadas que prestam serviços aos governos, levando carga e passageiros para suas missões fora do planeta. As reações a seguir, representam as duas principais reações de oxirredução envolvidas na queima dos combustíveis sólidos dos foguetes:
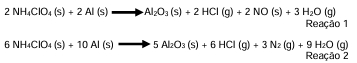
Analisando ambas as reações combinadas, fica evidente que o alumínio passa do estado de oxidação (zero) para (3+), enquanto o cloro passa de (+7) para (-1). Assim, pode-se concluir nessa análise que o estado de oxidação de nitrogênio vai de
Concurso:
Prefeitura de Santos
Disciplina:
Engenharia Química e Química Industrial
A reação de queima do alumínio na oxirredução que envolve o poderoso oxidante perclorato de amônio e forma tri-óxido-de-di-alumínio (responsável pelo interminável rastro branco deixado nos céus durante os lançamentos), ácido clorídrico, gás nitrogênio, óxido nitroso, e água. Em seu balanço de massa, vemos que 69,6% do peso é referente ao oxidante, enquanto o combustível (alumínio metálico) corresponde a 16%. Imagina-se que para atingir o ponto de queima de metais, temos de superar uma importante energia de ativação. Por conta disso, temos a participação de um catalizador à base de óxido de ferro (0,4% do peso da mistura). Fundamental nesse sistema, temos ainda 12,04% de um polímero aglutinante (para manter os ingredientes posicionados e garantir a continuidade da combustão). Afinal temos uma força explosiva tentando separar toda a mistura e não contamos com a convergente força da gravidade, que temos sempre quando estamos com os pés na terra. O complemento é dado por 1,96% do peso total em um agente à base de resina epóxi para assegurar a cura do polímero aglutinante. Sem contar que esse tipo de combustível, depois de aceso no foguete, não pode ser parado. Realmente, avançamos muito nos processos, ingredientes e tecnologias da combustão desde que começamos a queimar galhos secos de árvores, incendiados com uma faísca vinda de duas pedras se chocando. Apesar dessa incrível jornada tecnológica, os processos de combustão seguem todos os princípios simples e semelhantes. Sobre o assunto, assinale a alternativa mais adequada para resumir a combustão.