Questões de Concurso
Filtrar
2.128 Questões de concurso encontradas
Página 207 de 426
Questões por página:
Questões por página:
O máximo trabalho, e portanto a máxima eficiência, que se consegue extrair de uma máquina térmica é obtido pelo ciclo de Carnot que teria eficiência 100% apenas se o reservatório térmico frio estivesse a 0K (a impossibilidade disso é conhecida como segunda Lei da Termodinâmica). O emprego prático do ciclo de Carnot é inviabilizado de aplicações em virtude das trocas de calor entre a fonte quente e a fonte fria se darem em processos isotérmicos que acabam limitados pelo excessivo tempo que demandariam. A máxima eficiência acessível de uma máquina térmica operando entre os reservatórios de temperatura a 27ºC e 127ºC é
Em meados do século XVIII o conceito de calor especifico e de calor latente não estavam ainda formulados, tarefa que foi resolvida entre 1761 e 1772 com trabalhos dos físicos Joseph Black e Johan Carl Wilcke. Por volta de 1749 predominava a expectativa de que a temperatura de equilíbrio térmico sempre estaria na proporção das massas ou dos volumes das substâncias, sem menção à essa característica intrínseca dos materiais.
“Conforme demonstrou o químico escocês Joseph Black (1728 - 1799) em uma de suas célebres experiências (…) em 1757, ao misturar água a 78ºC com a mesma quantidade de gelo a 0ºC, observou que o gelo se fundiu todo mantendo-se, no entanto, em 0ºC.”
“A crônica do Calor: Calorimetria”, J.M.F. Bassalo, Revista Brasileira do Ensino de Física, Vol.14 (1),1992, p.29.
Em experimentos de calorimetria são comuns desvios sensíveis entre valores observados e calculados com modelos ideais. Considerando o experimento de Black narrado por Bassalo segundo o modelo ideal em que há apenas trocas de calor entre a água, calor específico de 1 cal/gºC, e o gelo, calor latente de fusão de 80 cal/g, assinale a alternativa que representaria a expectativa teórica ideal.
“Conforme demonstrou o químico escocês Joseph Black (1728 - 1799) em uma de suas célebres experiências (…) em 1757, ao misturar água a 78ºC com a mesma quantidade de gelo a 0ºC, observou que o gelo se fundiu todo mantendo-se, no entanto, em 0ºC.”
“A crônica do Calor: Calorimetria”, J.M.F. Bassalo, Revista Brasileira do Ensino de Física, Vol.14 (1),1992, p.29.
Em experimentos de calorimetria são comuns desvios sensíveis entre valores observados e calculados com modelos ideais. Considerando o experimento de Black narrado por Bassalo segundo o modelo ideal em que há apenas trocas de calor entre a água, calor específico de 1 cal/gºC, e o gelo, calor latente de fusão de 80 cal/g, assinale a alternativa que representaria a expectativa teórica ideal.
A hidreletricidade ocupa posição central na matriz energética brasileira. A usina de Itaipu em particular é a maior usina hidrelétrica em operação no país e conta com um desnível (em relação às turbinas) para seu nível máximo de cerca de 200 m. A densidade da água é de 1kg/litro, admitindo o caso com o reservatório em sua capacidade máxima e que não houvesse perda de energia na cadeia de transformação da energia potencial da água em energia elétrica e no seu transporte ao local de consumo, a quantidade de litros de água que precisaria atravessar as turbinas da usina para abastecer a energia elétrica consumida por um chuveiro de 7500W operando a 80% de sua potência máxima durante um banho de 10min é de:
James P. Joule em junho de 1849 publicou o trabalho sob o título On the mechanical equivalent of Heat (Sobre o equivalente mecânico do calor), encaminhando de maneira determinante o estabelecimento da Lei da Conservação da Energia em meados do século XIX. Em sua última conclusão após a série de experimentos Joule escreve:
[Conforme demonstrado pelos experimentos contidos neste trabalho:] A quantidade de calor capaz de aumentar a temperatura de uma libra de água [0,45kg] de 1ºF necessita para sua realização uma quantidade de energia mecânica correspondente àquela disponível na queda de uma massa de 772 libras [350kg] a uma distância de um pé [30,5cm].
Adaptado de James Prescott Joule Philosophical Transactions of the Royal Society of London Vol.140 (1850), pp.61-82.
Por definição a unidade caloria que foi inventada para medir calor tinha como referência o calor específico da água, c =1 cal/gºC. Ao passo que joule é a unidade derivada para energia na mecânica. A equivalência entre duas quantidades físicas só pode se dar se elas puderem ser convertidas uma na outra. Dados: pontos do gelo e do vapor na escala Farenheit, respectivamente: 32ºF e 212ºF, considere g=10m/s² . A conclusão de Joule leva aproximadamente a:
[Conforme demonstrado pelos experimentos contidos neste trabalho:] A quantidade de calor capaz de aumentar a temperatura de uma libra de água [0,45kg] de 1ºF necessita para sua realização uma quantidade de energia mecânica correspondente àquela disponível na queda de uma massa de 772 libras [350kg] a uma distância de um pé [30,5cm].
Adaptado de James Prescott Joule Philosophical Transactions of the Royal Society of London Vol.140 (1850), pp.61-82.
Por definição a unidade caloria que foi inventada para medir calor tinha como referência o calor específico da água, c =1 cal/gºC. Ao passo que joule é a unidade derivada para energia na mecânica. A equivalência entre duas quantidades físicas só pode se dar se elas puderem ser convertidas uma na outra. Dados: pontos do gelo e do vapor na escala Farenheit, respectivamente: 32ºF e 212ºF, considere g=10m/s² . A conclusão de Joule leva aproximadamente a:
A “Lei de resfriamento de Newton” consiste de um modelo simples para a dinâmica da temperatura T de um corpo inicialmente a uma temperatura T0 , que troca calor com o ambiente, a uma temperatura TR < T0, em uma taxa proporcional apenas à diferença entre a temperatura do corpo e do meio exterior. A taxa de condução do calor entre o corpo e o meio que depende de características físicas como a superfície de contato entre o corpo e o meio é contabilizada em termos efetivos pela constante positiva k. A equação do modelo está representada na imagem abaixo. No gráfico temos o resultado do experimento conduzido para uma pequena quantidade de glicerina (10 cm³ ) em um tubo de ensaio a uma temperatura inicial T0 =100ºC sendo a temperatura do ambiente TR = 21ºC. O perfil observado é aproximadamente exponencial. 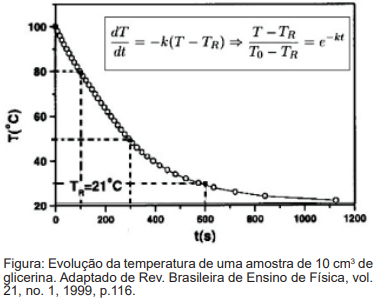 Considerando 1/e = 0,37. O valor da constante k para esse experimento é de aproximadamente:
Considerando 1/e = 0,37. O valor da constante k para esse experimento é de aproximadamente:
 Considerando 1/e = 0,37. O valor da constante k para esse experimento é de aproximadamente:
Considerando 1/e = 0,37. O valor da constante k para esse experimento é de aproximadamente: