Questões de Concurso
Filtrar
58 Questões de concurso encontradas
Página 8 de 12
Questões por página:
Analise as Leis da Termodinâmica relacionadas por PW Atkins (2009), em seu livro Físico‐Química.
I. A entropia do universo tende a aumentar.
II. A energia interna de um sistema isolado é constante.
III. A velocidade de variação de momento é igual à força.
IV. As entropias de todas as substâncias perfeitamente cristalinas são as mesmas em T = 0.
É descrita como a Segunda Lei da Termodinâmica apenas a afirmativa
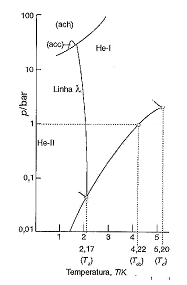
Sobre o diagrama de fases do hélio (4He), analise as afirmativas a seguir.
I. A linha λ assinala as condições para as quais a fase líquida e a fase sólida do hélio estão em equilíbrio. II. O He-II é um superfluido. III. As identificações ach e acc referem-se a fases sólidas distintas com estruturas diferentes do agrupamento dos átomos: uma delas é o agrupamento compacto hexagonal, ach; e a outra, o agrupamento compacto cúbico, acc.
Está(ão) correta(s) apenas a(s) afirmativa(s)
O estado mais simples da matéria é um gás, uma forma da matéria que ocupa qualquer recipiente que a contenha. É conveniente imaginar um gás como um conjunto de moléculas em movimento permanente e aleatório, com velocidades médias que aumentam quando a temperatura se eleva. Um gás difere de um líquido pelo fato de ter suas moléculas muito separadas umas das outras. Sobre os gases, marque V para as afirmativas verdadeiras e F para as falsas.
( ) O tamanho das moléculas é desprezível no sentido de que seus diâmetros são muito menores do que a distância média percorrida entre as colisões.
( ) Um gás real tem o comportamento tanto mais semelhante ao de um gás perfeito quanto mais alta for a pressão.
( ) A velocidade média quadrática das moléculas de um gás é proporcional à raiz quadrada da temperatura e à raiz quadrada da massa molar.
( ) As leis de Boyle e de Charles são exemplos de uma lei limite.
A sequência está correta em
Alguns fatores ocorrem naturalmente, outras não. Um gás, por exemplo, se expande até ocupar todo o volume disponível que lhe é oferecido. Um corpo quente se resfria até atingir a temperatura das suas vizinhanças, e uma reação química avança preferencialmente num sentido e não no sentido inverso. O reconhecimento da existência de duas classes de processos, os espontâneos e os não espontâneos, é resumido pela Segunda Lei da Termodinâmica. Sobre o tema, analise as afirmativas a seguir.
(Considere: ln 2 = 0,69.
ln 2,8 = 1,03.)
I. A variação de entropia de um gás perfeito quando ele se expande isotermicamente do volume Vi até o volume Vf é 8,62 JK–1
II. A variação de entropia do argônio, que está inicialmente a 25°C e 1,00 bar, num recipiente de 0,500 dm3 de volume e que se expande até o volume de 1,000 dm3, sendo simultaneamente aquecido até 100°C é 0,173 JK–1 .
III. Num ciclo termodinâmico, a variação global de uma função de estado (do estado inicial até o estado final e então de volta para o estado inicial) é igual a zero.
Está(ão) correta(s) apenas a(s) afirmativa(s)