Questões de Concurso
Filtrar
58 Questões de concurso encontradas
Página 9 de 12
Questões por página:
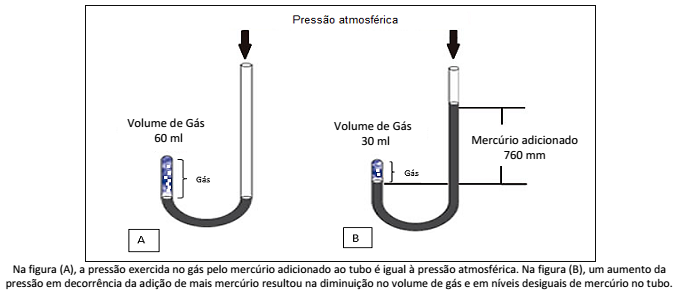
Essa imagem evidencia a relação inversa existente entre a pressão e o volume. Essa teoria se aplica à lei (de):
“A termodinâmica química estuda, entre outras coisas, as mudanças de energia que acompanham as reações químicas.”
(Fundamentos de Química Experimental, Maurício Gomes Constantino.)
Em relação à termoquímica, marque V para as afirmativas verdadeiras e F para as falsas.
( ) A máxima quantidade de energia que um sistema químico pode produzir é medida pela variação de energia livre: ΔG.
( ) Na entalpia da transformação, as medidas são geralmente efetuadas não mantendo uma pressão constante e é representada como ΔH.
( ) Uma reação na qual o calor é absorvido (a temperatura da mistura de reação diminui quando reage) é chamada de endotérmica e o ΔH é positivo.
( ) Uma reação na qual o calor é perdido pelos reagentes para o meio ambiente (a temperatura da mistura de reação aumenta quando reage) é dita exotérmica, onde ΔH é negativo.
A sequência está correta em
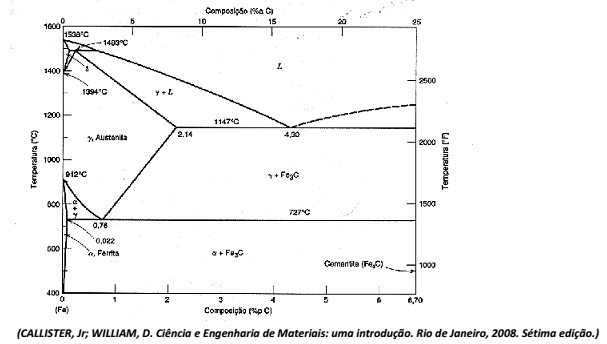
Para um aço contendo 81% de perlita, as porcentagens de ferrita e cementita são, respectivamente:
A reação de síntese da amônia em fase gasosa
3H2 (g) + N2 (g) 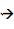 2NH3 (g)
2NH3 (g)
é acompanhada por variações de entalpia e de entropia do sistema.
As variações de entalpia (kJ) e entropia (J.K–1 ) em função da temperatura são apresentadas nas figuras a seguir.
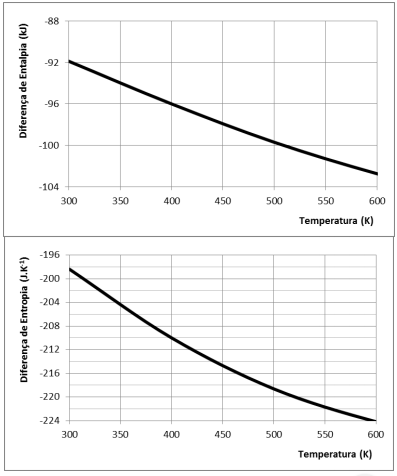
Utilizando os dados apresentados, o valor da energia livre de Gibbs, em kJ, a 400 K é de
Observe o gráfico que demonstra a região de duas fases e a continuidade dos estados.
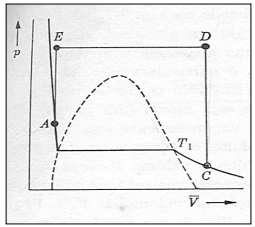
De acordo com a figura anterior, analise as afirmativas a seguir.
I. Os pontos A e C pertencem à mesma isoterma.
II. O ponto C representa um estado gasoso e o ponto A um sólido obtido comprimindo-se o gás isotermicamente.
III. A reta EA mostra quando o volume é mantido constante e o gás é resfriado, diminuindo a pressão.
IV. Em nenhum instante dessa série de mudanças o ponto que representa o estado do gás passou através da região de duas fases.
Estão corretas as afirmativas