Questões de Concurso
Filtrar
47 Questões de concurso encontradas
Página 2 de 10
Questões por página:
Questões por página:
Concurso:
Universidade Federal Fluminense (UFF)
Disciplina:
Química
Em relação ao equilíbrio químico no sangue, são feitas as seguintes afirmativas:
I O equilíbrio químico e os sistemas-tampão têm um papel importante no organismo humano e de outros animais.
II Nos seres humanos, o pH do plasma sanguíneo normalmente está entre 6,0 e 7,45.
III Se, por algum distúrbio, o valor do pH ficar acima de 7,8 ou abaixo de 6,8, a pessoa pode sofrer danos irreversíveis no cérebro ou até falecer.
IV Um exemplo de sistema em equilíbrio no sangue é aquele que envolve a respiração celular.
Das afirmativas acima, estão corretas apenas:
Concurso:
Universidade Federal Fluminense (UFF)
Disciplina:
Química
16g de anidrido sulfúrico são aquecidos num tubo fechado de capacidade igual a 10,0L, à temperatura constante de 1000°C. Estabelecendo-se o equilíbrio, verifica-se a formação de 1,92g de gás oxigênio. A constante “Kc” da dissociação do anidrido sulfúrico a 1000°C é de:
Disciplina:
Química
A tabela a seguir corresponde aos valores encontrados para Kc em determinada temperatura, para o equilíbrio químico da ração de formação do monóxido de nitrogênio. Nesta reação, sabemos que 1 mol de gás nitrogênio no estado gasoso, reage com 1 mol de gás oxigênio no estado gasoso, formando 2 mols de monóxido de nitrogênio gasoso.
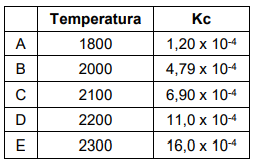
Diante dos valores acima, assinale a alternativa que apresenta maior concentração de monóxido de nitrogênio.

Diante dos valores acima, assinale a alternativa que apresenta maior concentração de monóxido de nitrogênio.
Considere um sistema em equilíbrio formado a partir da reação entre o ácido fluorídrico e o íon oxalato, sendo Keq a constante de equilíbrio.
2HF(aq) + C2O42-(aq) ? 2F-(aq) + H2C2O4(aq) Keq
Sabe-se ainda que
(I) HF(aq) ? H+ (aq) + F– (aq) K1
(II) H2C2O4 (aq) ? 2H+ (aq) + C2O4 2– (aq) K2
O valor da constante de equilíbrio Keq pode ser expresso em função das constantes K1 e K2 pela expressão
2HF(aq) + C2O42-(aq) ? 2F-(aq) + H2C2O4(aq) Keq
Sabe-se ainda que
(I) HF(aq) ? H+ (aq) + F– (aq) K1
(II) H2C2O4 (aq) ? 2H+ (aq) + C2O4 2– (aq) K2
O valor da constante de equilíbrio Keq pode ser expresso em função das constantes K1 e K2 pela expressão
mostrar texto associado
A composição de uma reação química em equilíbrio tende a mudar quando as condições do sistema reacional são alteradas. Analise as afirmações I, II e III a seguir.
I. A adição do catalisador óxido de vanádio V (V2O5) ao sistema em equilíbrio 2SO2(g) + O2(g) ⇌ 2SO3(g) promoverá aumento do rendimento do processo.
II. O aumento da pressão total sobre o sistema em equilíbrio Ni(s) + 4 CO(g) ⇌ Ni(CO)4(g) fará com que a concentração de monóxido de carbono diminua.
III. A diminuição da temperatura no sistema em equilíbrio CH4(g) + H2O(g) ⇌ CO(g) + 3H2(g) (ΔH0 = +206 kJ) causará deslocamento da reação para o sentido direto.
Está correto o que se afirma em
I. A adição do catalisador óxido de vanádio V (V2O5) ao sistema em equilíbrio 2SO2(g) + O2(g) ⇌ 2SO3(g) promoverá aumento do rendimento do processo.
II. O aumento da pressão total sobre o sistema em equilíbrio Ni(s) + 4 CO(g) ⇌ Ni(CO)4(g) fará com que a concentração de monóxido de carbono diminua.
III. A diminuição da temperatura no sistema em equilíbrio CH4(g) + H2O(g) ⇌ CO(g) + 3H2(g) (ΔH0 = +206 kJ) causará deslocamento da reação para o sentido direto.
Está correto o que se afirma em