Questões de Concurso
Filtrar
47 Questões de concurso encontradas
Página 6 de 10
Questões por página:
Questões por página:
A extração ácido-base do produto natural lapachol (C15H14O3) de serragem de madeira do ipê, planta pertencente à família das bignoniáceas, envolve as reações mostradas nas equações 1 e 2. O lapachol possui atividade anticâncer e antibacteriana. Equação 1
2C15H14O3(s) + Na2CO3(aq) ⇔ 2C15H13O3-Na+ (aq) + CO2(aq) + H2O(ℓ) composto amarelo-claro, insolúvel em água sal de sódio do lapachol, vermelho, solúvel em água Equação 2
C15H13O3-Na+ (aq) + HCl(aq) ⇔ C15H14O3(S) + NaCl(aq) Através da análise das equações 1 e 2 acima é INCORRETO afirmar:
2C15H14O3(s) + Na2CO3(aq) ⇔ 2C15H13O3-Na+ (aq) + CO2(aq) + H2O(ℓ) composto amarelo-claro, insolúvel em água sal de sódio do lapachol, vermelho, solúvel em água Equação 2
C15H13O3-Na+ (aq) + HCl(aq) ⇔ C15H14O3(S) + NaCl(aq) Através da análise das equações 1 e 2 acima é INCORRETO afirmar:
Considere a reação: C(s) + CO2(g) ⇔ 2CO(g) Em condições de equilíbrio a uma determinada temperatura, as pressões parciais de CO(g) e CO2(g) são 1,22 atm e 0,780 atm, respectivamente. Podemos afirmar que o valor da constante de equilíbrio para esta reação é
A reação 2HI(g) 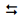 H2 (g) + I2 (g) foi estudada por inúmeros pesquisadores em diversas temperaturas e condições iniciais. Em um dos estudos, a reação foi conduzida em determinada temperatura constante e em vaso de 1,00 L, carregado inicialmente apenas com HI. Verificou-se que, no equilíbrio, apenas 20% do HI inicial se dissociaram. Com base nesses dados, foi possível calcular a constante de equilíbrio da reação. Assinale a opção que apresenta o valor correto da constante de equilíbrio Kc.
H2 (g) + I2 (g) foi estudada por inúmeros pesquisadores em diversas temperaturas e condições iniciais. Em um dos estudos, a reação foi conduzida em determinada temperatura constante e em vaso de 1,00 L, carregado inicialmente apenas com HI. Verificou-se que, no equilíbrio, apenas 20% do HI inicial se dissociaram. Com base nesses dados, foi possível calcular a constante de equilíbrio da reação. Assinale a opção que apresenta o valor correto da constante de equilíbrio Kc.
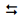 H2 (g) + I2 (g) foi estudada por inúmeros pesquisadores em diversas temperaturas e condições iniciais. Em um dos estudos, a reação foi conduzida em determinada temperatura constante e em vaso de 1,00 L, carregado inicialmente apenas com HI. Verificou-se que, no equilíbrio, apenas 20% do HI inicial se dissociaram. Com base nesses dados, foi possível calcular a constante de equilíbrio da reação. Assinale a opção que apresenta o valor correto da constante de equilíbrio Kc.
H2 (g) + I2 (g) foi estudada por inúmeros pesquisadores em diversas temperaturas e condições iniciais. Em um dos estudos, a reação foi conduzida em determinada temperatura constante e em vaso de 1,00 L, carregado inicialmente apenas com HI. Verificou-se que, no equilíbrio, apenas 20% do HI inicial se dissociaram. Com base nesses dados, foi possível calcular a constante de equilíbrio da reação. Assinale a opção que apresenta o valor correto da constante de equilíbrio Kc. Sobre a Lei de Chatelier e o equilíbrio químico na fase gasosa, assinale a afirmativa INCORRETA.
Sobre equilíbrio químico, considere as afirmativas a seguir e assinale a alternativa correta:
I. As reações não vão até o fim. Elas continuam até que a composição da mistura reacional corresponda ao mínimo de entalpia. Essa composição é descrita por uma constante de equilíbrio característica da reação que depende da temperatura, dentre outros fatores. II. Para controlar o rendimento de uma reação, precisamos entender a base termodinâmica do equilíbrio e como a posição atual de equilíbrio é afetada por condições como a temperatura e a pressão, por exemplo. III. O equilíbrio químico é o estágio da reação química em que não existe mais tendência a mudar a composição da mistura da reação, isto é, as concentrações ou pressões parciais dos reagentes e produtos. Como os equilíbrios físicos, todos os equilíbrios químicos são dinâmicos, com a reação direta e inversa ocorrendo com a mesma velocidade. IV. A termodinâmica descreve quantitativamente o equilíbrio, o que nos possibilita controlar a direção e o rendimento das reações. V. A composição de uma mistura de reação no equilíbrio é descrita pela constante de equilíbrio, que é dependente do produto das atividades dos produtos (elevadas a potências iguais aos coeficientes estequiométricos da equação química balanceada da reação) dividido pelo produto das atividades dos reagentes (elevadas a potências iguais a seus coeficientes estequiométricos).
Assinale a alternativa correta:
I. As reações não vão até o fim. Elas continuam até que a composição da mistura reacional corresponda ao mínimo de entalpia. Essa composição é descrita por uma constante de equilíbrio característica da reação que depende da temperatura, dentre outros fatores. II. Para controlar o rendimento de uma reação, precisamos entender a base termodinâmica do equilíbrio e como a posição atual de equilíbrio é afetada por condições como a temperatura e a pressão, por exemplo. III. O equilíbrio químico é o estágio da reação química em que não existe mais tendência a mudar a composição da mistura da reação, isto é, as concentrações ou pressões parciais dos reagentes e produtos. Como os equilíbrios físicos, todos os equilíbrios químicos são dinâmicos, com a reação direta e inversa ocorrendo com a mesma velocidade. IV. A termodinâmica descreve quantitativamente o equilíbrio, o que nos possibilita controlar a direção e o rendimento das reações. V. A composição de uma mistura de reação no equilíbrio é descrita pela constante de equilíbrio, que é dependente do produto das atividades dos produtos (elevadas a potências iguais aos coeficientes estequiométricos da equação química balanceada da reação) dividido pelo produto das atividades dos reagentes (elevadas a potências iguais a seus coeficientes estequiométricos).
Assinale a alternativa correta: