Questões de Concurso
Filtrar
47 Questões de concurso encontradas
Página 9 de 10
Questões por página:
Questões por página:
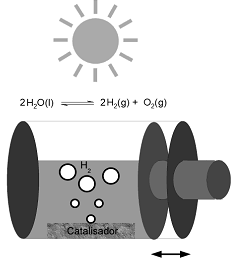
Recentemente, a produção fotocatalítica de hidrogênio vem atraindo atenção devido ao processo que gera um combustível limpo, o qual é utilizado em células a combustível. O processo se baseia na separação da água nos seus componentes, conforme equilíbrio inserido no esquema, utilizando luz solar e um fotocatalisador (p. ex. NaTaO3:La). O processo é extremamente endotérmico, necessitando 1,23 eV para ocorrer. Num experimento, o processo foi realizado num sistema fechado, como esquematizado abaixo. Considerando essas informações, identifique as afirmativas a seguir como verdadeiras (V) ou falsas (F):
( ) A quantidade de fotocatalisador limita a conversão.
( ) O aumento da temperatura irá favorecer a conversão.
( ) A diminuição do volume do sistema irá favorecer a conversão.
( ) É condição necessária para a produção de hidrogênio que o fotocatalisador absorva energia solar superior a 1,23 eV.
Assinale a alternativa que apresenta a sequência correta, de cima para baixo.
O dióxido de nitrogênio, proveniente da queima de combustíveis fósseis, é uma das espécies que mais contribui para o efeito da chuva ácida. A reação química que provoca a diminuição do pH da água da chuva é representada pelo equilíbrio a seguir:
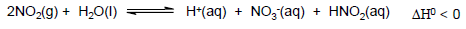
Num ensaio em laboratório, foram acondicionados num sistema fechado N2(g), O2(g), NO2(g) e vapor de água que está em equilíbrio com água líquida. A partir desses dados, considere as seguintes afirmações:
1. O aumento na pressão total do sistema tenderá a diminuir o pH da solução dentro do sistema.2. Um aquecimento brando tenderá a aumentar o pH da solução dentro do sistema.3. A adição de excesso de água líquida no sistema tenderá a deslocar o equilíbrio, diminuindo o pH da solução dentro do sistema.4. A contribuição do ácido nitroso (HNO2) para o pH da solução dentro do sistema é desprezível.
Assinale a alternativa correta
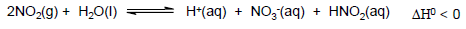
Num ensaio em laboratório, foram acondicionados num sistema fechado N2(g), O2(g), NO2(g) e vapor de água que está em equilíbrio com água líquida. A partir desses dados, considere as seguintes afirmações:
1. O aumento na pressão total do sistema tenderá a diminuir o pH da solução dentro do sistema.2. Um aquecimento brando tenderá a aumentar o pH da solução dentro do sistema.3. A adição de excesso de água líquida no sistema tenderá a deslocar o equilíbrio, diminuindo o pH da solução dentro do sistema.4. A contribuição do ácido nitroso (HNO2) para o pH da solução dentro do sistema é desprezível.
Assinale a alternativa correta
mostrar texto associado
O grau de ionização da amônia nessa temperatura e a concentração hidrogeniônica da solução mais diluída são, respectivamente,
O aumento de pressão do sistema acarretará maior rendimento em produto do equilíbrio representado por:
