Questões de Concurso
Filtrar
57 Questões de concurso encontradas
Página 11 de 12
Questões por página:
Questões por página:
A água oxigenada – H2O2(aq) – se decompõe produzindo água e gás oxigênio, de acordo com a equação: H2O2(aq) → H2O(ℓ) + ½ O2(g) O gráfico abaixo foi construído a partir de dados experimentais e mostra a variação da concentração de água oxigenada em função do tempo:
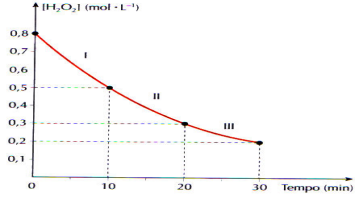 Calcule a velocidade média de decomposição da água oxigenada, em mol.L-1.min-1, nos intervalos I, II, I e no intervalo de 0 a 30 min:
Calcule a velocidade média de decomposição da água oxigenada, em mol.L-1.min-1, nos intervalos I, II, I e no intervalo de 0 a 30 min:
 Calcule a velocidade média de decomposição da água oxigenada, em mol.L-1.min-1, nos intervalos I, II, I e no intervalo de 0 a 30 min:
Calcule a velocidade média de decomposição da água oxigenada, em mol.L-1.min-1, nos intervalos I, II, I e no intervalo de 0 a 30 min:
Questão Anulada
A reação entre metanol e ácido bromídrico segue o seguinte mecanismo:
(1) CH3OH + H+ ↔ CH3OH2+ (rápida)
(2) CH3OH2 + → CH3OH + H+ (rápida)
(3) CH3OH2 + + Br- → CH3Br + H2O (lenta)
A partir deste mecanismo, indique a alternativa que apresenta a lei de velocidade de formação do brometo de metila, d[CH3Br]/dt, por meio da citada reação.
A concentração inicial do princípio ativo de um fármaco é 4,0.10-3 g/mL. Após 10,0 meses estocado, esta concentração foi reduzida para 2,0.10-3 g/mL, em virtude da decomposição do composto ativo. Considerando que o fármaco torna-se ineficaz, quando 20% do princípio ativo são decompostos e que isto ocorre por um mecanismo de primeira ordem, assinale a alternativa que apresenta o período de tempo a partir do qual o fármaco torna-se ineficaz.
Na seguinte tabela, são apresentados os dados referentes a três experimentos de combustão do monóxido de carbono, conduzidos à temperatura de 300 K, em atmosfera padrão.
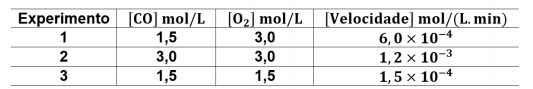
Com base nesses experimentos, a ordem global da reação é igual a
A cinética da reação de zinco metálico com solução aquosa de ácido clorídrico foi avaliada pelo acompanhamento do volume de H2 formado em função do tempo.
Nesta avaliação, diversos experimentos foram conduzidos, modificando alguns parâmetros iniciais como temperatura, concentração inicial do ácido e estado de agregação do zinco metálico.
Assinale a opção que apresenta um perfil de volume de H2 em função do tempo esperado para um par de experimentos, variando entre eles apenas um dos parâmetros.
Nesta avaliação, diversos experimentos foram conduzidos, modificando alguns parâmetros iniciais como temperatura, concentração inicial do ácido e estado de agregação do zinco metálico.
Assinale a opção que apresenta um perfil de volume de H2 em função do tempo esperado para um par de experimentos, variando entre eles apenas um dos parâmetros.