Questões de Concurso
Filtrar
57 Questões de concurso encontradas
Página 8 de 12
Questões por página:
Se colocados 100,0 g de Al(s) e 40,0 g de Cr2 O3 em alta temperatura, ocorrerá uma reação de oxidação de alumínio seguindo a reação: 2 Al(s) + Cr2 O3 (s) → Al2 O3 (s) + 2 Cr(l). Identifique qual será o reagente limitante desta reação e quantifque (em gramas) o excesso de reagente que permanece sem reagir. Dados: 1 mol de Al = 27 g Al,1 mol de Cr2 O3 = 152,0 g Cr2 O3 .
Assinale a alternativa que possui ambas respostas corretas.
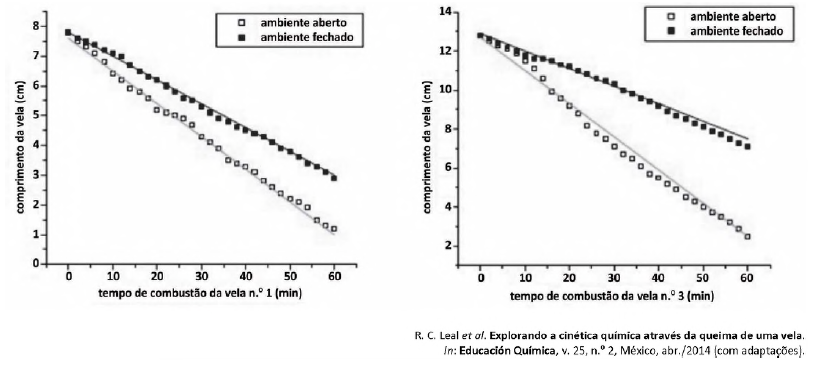
Acerca da variação na velocidade de queima das velas, assinale a alternativa correta.
O monóxido de nitrogênio, quando liberados pelos automóveis na baixa atmosfera, rapidamente se transforma em dióxido de nitrogênio, que em seguida, irá colaborar na formação do ozônio troposférico, um poluente. Um estudo dessa reação no laboratório revelou que, para que ela se tornasse quatro vezes mais rápida, poderia ser feita a seguinte alteração: manter fixa a concentração de O2 e duplicar a de NO.
Considerando o enunciado acima, atente para as seguintes afirmações:
I. A lei da velocidade dessa reação pode ser dada por: v = k[NO]2 [O2].
II. Essa deve ser uma reação elementar, ou seja, realizada em apenas uma etapa. Sobre essas afirmações, é correto diz que