Questões de Concurso
Filtrar
52 Questões de concurso encontradas
Página 2 de 11
Questões por página:
Questões por página:
Disciplina:
Química
Deseja-se construir um sistema eletroquímico contendo um catodo de cobre (no qual o metal estará imerso em uma solução aquosa de nitrato de cobre) e um anodo de alumínio (no qual o metal estará imerso em solução aquosa de sulfato de alumínio). Os dois eletrodos estarão conectados por uma ponte salina, contendo solução aquosa de nitrato de potássio e, externamente, por um fio de cobre condutor.
[Dados. Potenciais de redução padrão:
E0Al3+|Al = -1,66 V; E0Cu2+|Cu = +0,34 V.]
Nessas condições, analise as afirmativas a seguir a respeito desse sistema eletroquímico:
I. Será uma pilha, pois a reação esperada é espontânea. II. A diferença de potencial esperada é 7,32V. III. Será uma reação espontânea se um potencial externo de 2,00V for aplicado ao sistema.
Está correto o que se afirma em
[Dados. Potenciais de redução padrão:
E0Al3+|Al = -1,66 V; E0Cu2+|Cu = +0,34 V.]
Nessas condições, analise as afirmativas a seguir a respeito desse sistema eletroquímico:
I. Será uma pilha, pois a reação esperada é espontânea. II. A diferença de potencial esperada é 7,32V. III. Será uma reação espontânea se um potencial externo de 2,00V for aplicado ao sistema.
Está correto o que se afirma em
mostrar texto associado
Em uma célula eletrolítica, a corrente elétrica é fornecida por uma fonte externa e usada para promover uma reação química não-espontânea. Atualmente essa é uma das possíveis formas de produção de hidrogênio gasoso a partir da eletrólise da água. Considere esse processo eletrolítico ocorrendo segundo as condições apresentadas na tabela a seguir:
Corrente Elétrica 10 A
Tempo 30 min
Pressão 1,0 atm
Temperatura 273 K
Sabendo que, nessas condições, foram recolhidos 1,7 L de gás hidrogênio é possível prever que o rendimento do processo foi, aproximadamente, de
(Dado: Constante de Faraday = 96.500 s.A.mol-1)
Corrente Elétrica 10 A
Tempo 30 min
Pressão 1,0 atm
Temperatura 273 K
Sabendo que, nessas condições, foram recolhidos 1,7 L de gás hidrogênio é possível prever que o rendimento do processo foi, aproximadamente, de
(Dado: Constante de Faraday = 96.500 s.A.mol-1)
O ferro metálico, amplamente utilizado na indústria, pode ser obtido a partir da redução do óxido ferroso (FeO) pelo monóxido de carbono (CO), de acordo com a equação abaixo, cuja variação de entalpia é desconhecida.
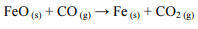
Caso essa reação seja realizada em etapas, as reações de cada etapa serão as seguintes, em que ∆Hn (n = 1,2 ou 3) representa a variação de entalpia da n-ésima etapa:
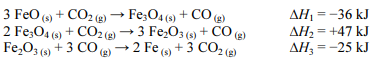
A partir da Lei de Hess, é possível calcular a variação de entalpia envolvida na primeira reação.
Nessa situação, considerando-se que MFe = 56 g/mol seja a massa molar do ferro, é correto concluir que a variação de entalpia envolvida na formação de 140 g de ferro metálico por meio da redução do óxido ferroso pelo monóxido de carbono é
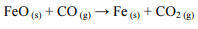
Caso essa reação seja realizada em etapas, as reações de cada etapa serão as seguintes, em que ∆Hn (n = 1,2 ou 3) representa a variação de entalpia da n-ésima etapa:
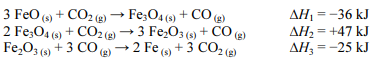
A partir da Lei de Hess, é possível calcular a variação de entalpia envolvida na primeira reação.
Nessa situação, considerando-se que MFe = 56 g/mol seja a massa molar do ferro, é correto concluir que a variação de entalpia envolvida na formação de 140 g de ferro metálico por meio da redução do óxido ferroso pelo monóxido de carbono é
Em meados do século XX, as pilhas alcalinas surgiram como uma alternativa muito mais eficiente energeticamente em comparação às pilhas tradicionais. Como mostra a seguinte figura, a pilha alcalina utiliza os mesmos eletrodos da tradicional, porém o seu eletrólito é uma solução aquosa de hidróxido de sódio concentrada (~30% em massa) contendo uma dada quantidade de óxido de zinco ― daí a denominação alcalina para essa pilha.
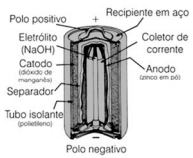
Internet:<http://qnesc.sbq.org.br> (com adaptações).
Como se sabe, os metais não se encontram de forma pura na natureza, é preciso extrair e posteriormente purificar para obtê-los sem resíduos (impurezas). O primeiro a realizar a façanha de purificar metais através da eletrólise foi Charles Hall, no ano de 1886. A Eletrólise é um método muito usado para este fim em razão da economia e eficiência desse método. No processo da eletrólise da alumina ( Al2O3 ), pode-se afirmar que