Questões de Concurso
Filtrar
52 Questões de concurso encontradas
Página 7 de 11
Questões por página:
Em seus compostos, o enxofre apresenta números de oxidação +6, +4, +2 e –2. São várias as espécies em solução ácida e básica. Nas espécies protonadas, os átomos de H estão ligados aos átomos de oxigênio dos oxiânicos. As espécies sulfuradas possuem diferentes potenciais padrão. Há de se notar que os oxiânicos de enxofre são agentes oxidantes muito mais fracos do que os de nitrogênio. Ainda sobre espécies de enxofre, analise as afirmativas a seguir.
I. Espécies no estado +6, no estado +4 e no estado +2 podem atuar apenas como agentes oxidantes, e nunca como agentes redutores, em reações redox.
II. Espécies no estado 0 (zero) podem atuar como agentes oxidantes ou como agentes redutores.
III. Espécies no estado –2 podem atuar apenas como agentes redutores, e nunca como agentes oxidantes, em reações redox.
Estão corretas as afirmativas
Utilize os dados abaixo para responder a questão 37.

Escreva as semi-reações de cátodo e ânodo e a equação balanceada para os sistemas representados a seguir. Em cada caso faça um esquema da célula galvânica, calcule o valor de ΔE° e determine se corresponde a uma pilha ou eletrólise. Na sequência, assinale a alternativa correta.
Sistemas:
I. Pt(s) | Fe2+(aq), Fe3+(aq) | | Ag+(aq) | Ag(s)
II. Pt(s) | Cl- (aq) | Cl2(g) | | H+(aq) | H2(g) | C(gr)
III. V(s) | V2+(aq) | | U3+(aq) | U(s)
IV. Hg(l) | Cl- (aq) | Hg2Cl2(s) | | Sn4+(aq), Sn2+(aq) | Pt(s)
Assinale a alternativa correta:
:
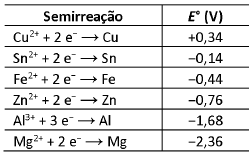
A proteção catódica é um método utilizado para a proteção de estruturas. Com isso, tubulações e tanques de estocagem, entre outros, são protegidos por esse método. Em uma aula de química, deseja-se estudar a proteção da corrosão de um equipamento constituído basicamente por ferro, empregando-se o método da proteção catódica com o uso de um metal de sacrifício. Nesse contexto, a tabela a seguir mostra os potenciais-padrão de redução (E°) de algumas espécies.
A bateria de carro é um gerador de energiarelativamente barato, tem uma vida útil longa e umarecarga fácil. As semirreações dos eletrodos queconstituem as seis células da bateria convencionalnão selada, são:
Pb(s) + H2SO4(aq) →
PbSO4(s) + 2 H + + 2e- e0 = 0,36 Volts
PbO2(s) + H2SO4(aq) + 2e- + 2H+ →
PbSO4(s) + 2 H2O(l) e0 = 1,69 Volts
Considerando o enunciado acima, é correto afirmar que