Questões de Concurso
Filtrar
59 Questões de concurso encontradas
Página 4 de 12
Questões por página:
Em 2019, é comemorado o aniversário de 150 anos da primeira versão da tabela periódica, proposta por Dmitri Mendeleev. Ele criou um sistema que, além de catalogar os elementos, permitiu prever propriedades em função da posição que o elemento ocupa na tabela. Em 1869, o sódio (Na) e o potássio (K) já constavam da primeira versão da tabela periódica. Na versão atual, esses elementos pertencem ao primeiro grupo, o dos metais alcalinos. Esses metais reagem de maneira violenta com água, na qual se produz gás hidrogênio, conforme esquematizado abaixo:
2 M (s) + 2 H2O (l) → 2 MOH (aq) + H2(g), M = Na ou K
A propriedade comum a esse grupo, que é responsável pelo comportamento descrito em água, é o:
I. Com relação à afinidade eletrônica, a ordem correta é P > Se > Na > Cu.
II. Um metal alcalino terroso do terceiro período apresenta menor raio atômico do que um metal do quinto período e do mesmo grupo.
III. A primeira energia de ionização dos elementos decresce de cima para baixo num grupo ou família.
Está(ão) correta(s) a(s) afirmativa(s)
A tabela periódica é uma das realizações mais notáveis da Química porque ajuda a organizar a extensa quantidade de propriedades dos elementos, que, de outra forma, seria um arranjo confuso. A tabela periódica pode ser usada na previsão de um grande número de propriedades, muitas das quais são cruciais para a compreensão das características químicas e físicas dos compostos.
Sobre as propriedades periódicas dos átomos, pode-se afirmar que
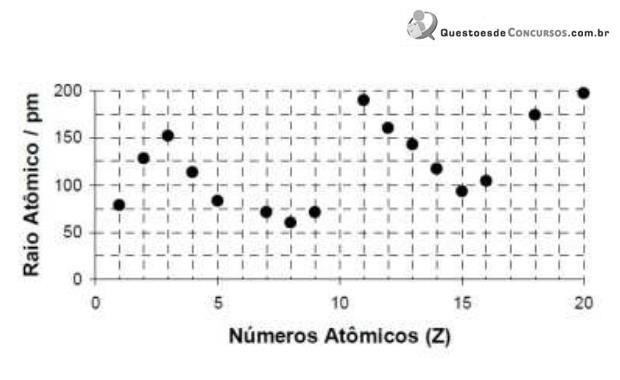
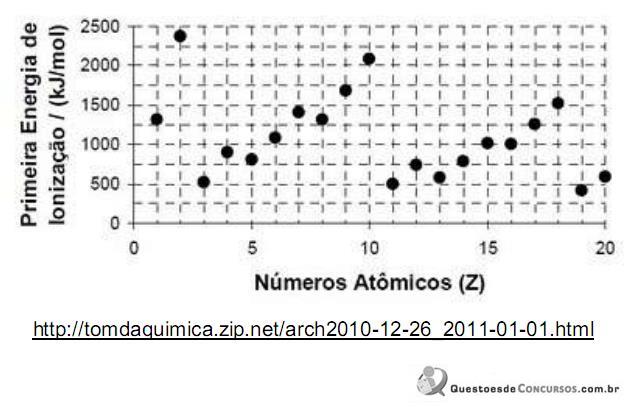
A explicação para o fato de a primeira energia de ionização do elemento sódio ser menor do que a do elemento fósforo é: