Questões de Concurso
Filtrar
59 Questões de concurso encontradas
Página 9 de 12
Questões por página:
Questões por página:
O posicionamento dos metaloides entre os metais e os não-metais é o nosso primeiro exemplo das tendências na variação das propriedades quando nos deslocamos na tabela periódica. Frequentemente veremos que, à medida que mudamos de posição em um período ou em um grupo, as propriedades físicas e químicas variam de modo mais ou menos regular. Há poucas variações abruptas nas características dos elementos quando nos deslocamos horizontalmente ao longo de um período ou verticalmente através de um grupo. (Brady, J.; Senese, F. Química a matéria e suas transformações Vol 1,5ª Ed. Rio de janeiro: LTC.2009) Com relação aos raios dos átomos, analise as afirmativas a seguir. I. O raio do ferro é menor que o raio do potássio. II. O raio do paládio é maior que o raio do níquel. III. O raio do manganês e maior que o raio do estrôncio Está correto o que se afirma em
Várias são as propriedades de metais de transição comparadas às dos metais do grupo principal, como podemos observar no quadro a seguir.
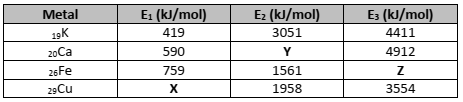
As letras X, Y e Z correspondem a valores de energia de ionização para os determinados elementos. Assinale a afirmativa correta em relação aos valores de X, Y ou Z.
Questão Anulada
Para a análise de cátions, dividimos, de modo geral, os cátions em três grupos (principal, transição e outros metais). Os demais são omitidos por serem muito tóxicos, muito caros ou relativamente raros. Para a realização da análise de cátions em uma mistura é requerido um tratamento sistemático. O procedimento, geralmente, consiste em remover sucessivos grupos de cátions por precipitação. O esquema padrão de análise qualitativa separa os cátions em quatro grupos, com reagentes e pH ajustados. Assinale a alternativa que classifica somente os metais para o grupo II de cátions em análise qualitativa.
Sobre a tabela periódica, em particular sobre energia de ionização, considere as afirmações a seguir: I. A primeira energia de ionização é maior para os elementos próximos do hélio e menor para os próximos do césio. II. A segunda energia de ionização é maior do que a primeira energia de ionização do mesmo elemento. III. Os metais são encontrados à esquerda da tabela periódica porque esses elementos têm baixa energia de ionização e podem perder elétrons facilmente. IV. Elementos com energias de ionização altas não devem formar cátions facilmente ou conduzir eletricidade. V. A energia de ionização é a energia necessária para remover um elétron de um átomo na fase gás. De certo modo ela é de fundamental importância para entender como as ligações químicas são formadas e, portanto, sobre as propriedades físicas das moléculas.
Assinale a alternativa correta:
Assinale a alternativa correta:
O estanho é um metal branco, prateado, maleável e dúctil. Apresenta número atômico (Z) igual a 50 e pertence ao grupo 14 da tabela periódica. Desde a antiguidade, o estanho é conhecido, sendo um dos primeiros elementos a serem utilizados pela tecnologia humana para produzir bronze, nos tempos pré-históricos. O estanho ocorre, na forma combinada na natureza, em minerais, sendo o seu principal minério a cassiterita (SnO2). Com base nessas informações, assinale a alternativa que apresenta a descrição da configuração eletrônica do Sn no estado fundamental.