Questões de Concurso
Filtrar
182 Questões de concurso encontradas
Página 4 de 37
Questões por página:
Questões por página:
A respeito dos conceitos de equilíbrio químico, entalpia, entropia e energia livre, assinale a alternativa correta.
O calorímetro é um instrumento utilizado na medição de calor - também chamado de energia térmica - envolvido em uma mudança de estado de um sistema, que pode envolver uma mudança de fase, de temperatura, de pressão, de volume, de composição química ou qualquer outra propriedade associada com trocas de calor.
No calorímetro da figura abaixo, que opera em volume constante,1000 moléculas de glicose foram queimadas.
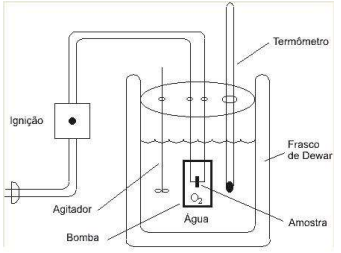
Figura: Bomba Calorimétrica. https://www.ebah.com.br/content/ABAAABOZIAG/bomba-calorimetrica
O calor do processo foi da ordem de 6397,5 KJ em temperatura igual a 25 °C. Dados: R = 8,314 JK-Mol- A variação de entalpia nesta reação foi igual a
No calorímetro da figura abaixo, que opera em volume constante,1000 moléculas de glicose foram queimadas.

Figura: Bomba Calorimétrica. https://www.ebah.com.br/content/ABAAABOZIAG/bomba-calorimetrica
O calor do processo foi da ordem de 6397,5 KJ em temperatura igual a 25 °C. Dados: R = 8,314 JK-Mol- A variação de entalpia nesta reação foi igual a
As células de combustíveis ou pilhas de hidrogênio usam gases como combustíveis. Em geral, têm três compartimentos. O primeiro contém hidrogênio (H2). No segundo compartimento, outro gás que será reagente como o gás oxigênio (O2). Ambos são separados por um terceiro compartimento, um ambiente onde estes gases irão se difundir passando pelos eletrodos e irão reagir, de tal forma que estas células convertem a energia liberada em reações de combustão dos gases em eletricidade. Esse tipo de pilha não se gasta, ou seja, os reagentes são continuamente injetados no aparelho durante o processo de oxirredução.
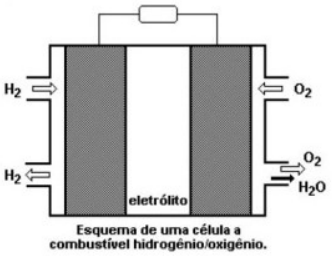
Sobre a pilha de hidrogênio, pode-se afirmar que

Sobre a pilha de hidrogênio, pode-se afirmar que
mostrar texto associado
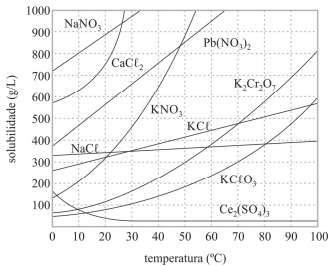
Com base no gráfico precedente, que apresenta as solubilidades em água de algumas substâncias, e considerando que as massas molares do NaNO3 e do KCl valham, respectivamente, 85,00 g/mol e 74,6 g/mol, julgue o próximo item.
As dissoluções dos sais apresentados no gráfico são processos endotérmicos.
As dissoluções dos sais apresentados no gráfico são processos endotérmicos.
mostrar texto associado
A partir do texto apresentado, e considerando que as massas molares do NaCl e do KCl valham, respectivamente,58,5 g/mol e 74,6 g/mol e que a constante de Avogadro valha 6 × 1023 mol−1, julgue o item a seguir.
A solução de sal light é classificada como eletrolítica e a sua condutibilidade elétrica é tão maior quanto menor for a sua concentração.