Questões de Concurso
Filtrar
2.837 Questões de concurso encontradas
Página 7 de 568
Questões por página:
Questões por página:
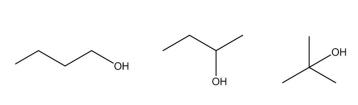
Dadas as afirmativas relacionadas a propriedades dos três isômeros do butanol da figura,
I. O 1-butanol apresenta o maior ponto de ebulição dentre os três compostos acima.
II. O 2-butanol apresenta o menor ponto de ebulição dentre os três compostos acima.
III. O 2-metil-2-propanol é o composto mais polar dessa série.
IV. O 1-butanol é o composto menos polar dessa série.
verifica-se que está/ão correta/s
Um frasco contendo uma solução de NaOH, de concentração desconhecida, foi encontrado no laboratório. Uma solução de HCl 2 M foi usada para titular a solução básica. Uma alíquota de 20 mL do titulado foi transferida para um Erlenmeyer, e fenolftaleína foi usada como indicador. O titulante foi transferido para uma vidraria específica, e foram necessários 12 mL para que o ponto de viragem fosse atingido.
O nome da vidraria usada e a concentração da solução de NaOH são, respectivamente,
O nome da vidraria usada e a concentração da solução de NaOH são, respectivamente,
O diamante (ou diagrama) de Hommel é uma ferramenta da simbologia na rotulagem de produtos químicos que permite a rápida visualização dos riscos associados a determinado produto. Esse símbolo associa cores a quatro tipos de riscos envolvendo um produto químico. Esses riscos são:
Um frasco de ácido clorídrico P. A. apresenta as seguintes informações: massa molar = 36,46 g/mol; densidade = 1,19 g/mL; concentração ≈ 37%. Sendo necessário preparar 1L de uma solução de HCl 0,5 M, a molaridade do HCl P. A. e a quantidade deste necessária para preparar a solução a 0,5 M são, respectivamente,
A reação de oxidação de Swern é usada para oxidar álcoois a aldeídos e cetonas. Essa reação ocorre na presença do álcool que se deseja oxidar, e dos reagentes cloreto de oxalila (C2O2Cl2), dimetil sulfóxido (C2H6SO) e trietilamina (C6H15N) dissolvidos em diclorometano (CH2Cl2). Durante o processo de oxidação, o dimetil sulfóxido (C2H6SO) é reduzido a dimetil sulfeto (C2H6S) que tem um cheiro desagradável; porém, de forma qualitativa, esse cheiro é um indicativo de que a reação de oxidação ocorreu.
Assinale a alternativa que apresenta a massa molecular (em u) do gás fétido liberado nessa reação. Dados da massa atômica em u: C = 12,01 u; H = 1,01 u; S = 32,07 u; O = 16,00 u; N = 14,01 u; Cl = 35,45 u.
Assinale a alternativa que apresenta a massa molecular (em u) do gás fétido liberado nessa reação. Dados da massa atômica em u: C = 12,01 u; H = 1,01 u; S = 32,07 u; O = 16,00 u; N = 14,01 u; Cl = 35,45 u.