Filtrar
72 Questões de concurso encontradas
Página 1 de 15
Questões por página:
Questões por página:
Concurso:
IF Farroupilha - RS
Disciplina:
Química
A eletroquímica envolve processos de oxidação e redução, tendo aplicações em diferentes áreas da ciência e da tecnologia. Sobre os conceitos de eletroquímica, analise as assertivas abaixo:
I. Em uma célula galvânica, a reação química ocorre de forma espontânea, convertendo energia química em energia elétrica.
II. O ânodo é o eletrodo onde ocorre a oxidação, independentemente de a célula ser galvânica ou eletrolítica.
III. Em uma célula eletrolítica, a corrente elétrica externa é utilizada para forçar uma reação química não espontânea.
IV. Na eletrólise da água, a decomposição da molécula ocorre devido à passagem de corrente elétrica, formando gás oxigênio e gás hidrogênio.
V. O fluxo de elétrons em um circuito externo ocorre do cátodo para o ânodo, pois os elétrons se movem espontaneamente para regiões de menor potencial elétrico.
Quais estão corretas?
I. Em uma célula galvânica, a reação química ocorre de forma espontânea, convertendo energia química em energia elétrica.
II. O ânodo é o eletrodo onde ocorre a oxidação, independentemente de a célula ser galvânica ou eletrolítica.
III. Em uma célula eletrolítica, a corrente elétrica externa é utilizada para forçar uma reação química não espontânea.
IV. Na eletrólise da água, a decomposição da molécula ocorre devido à passagem de corrente elétrica, formando gás oxigênio e gás hidrogênio.
V. O fluxo de elétrons em um circuito externo ocorre do cátodo para o ânodo, pois os elétrons se movem espontaneamente para regiões de menor potencial elétrico.
Quais estão corretas?
Um sistema coulométrico foi usado para a determinação de concentração hidrogeniônica (H+) de uma solução. Este consistia de duas meias-células, cada uma contendo um eletrodo de Pt e um eletrólito forte dissolvido, sendo as duas meias- -células conectadas por ponte salina de KNO3 . Ao se acionar o sistema, no eletrodo de trabalho se formou gás O2, e no contra-eletrodo, o gás H2 . Adicionou-se vermelho de bromofenol à meia-célula que continha o eletrodo de trabalho, que indicou, pela mudança de cor, o momento em que a amostra atingiu pH neutro. Nesse sistema, realizou-se uma análise de 100,00 mL de solução de pH 4,00, aplicando-se corrente constante de 50,0 mA. Considerando-se esse sistema, verifica-se que
Dado F = 96.500 C mol-1
Dado F = 96.500 C mol-1
Conforme prevê a equação de Nernst, o potencial padrão de uma célula eletroquímica de trabalho pode variar devido à mudança de alguns parâmetros. Dessa maneira, mantendo os demais parâmetros sem alteração, o potencial elétrico de determinada célula eletroquímica irá:
Sistemas de células a combustível são uma fonte de energia elétrica limpa, eficiente, confiável e silenciosa. Não precisam ser recarregadas periodicamente como as baterias, em vez disso continuam a produzir energia elétrica enquanto forem alimentadas por um combustível. Uma das montadoras mais conhecidas, a Toyota, lançou em março deste ano o Mirai, de segunda geração, que é um veículo elétrico cuja energia não provém de uma bateria, mas de um dispositivo chamado célula a combustível — também pode ser chamado de pilha a combustível, como dizem os franceses (pile à combustible).
Adaptado. CÉLULA A COMBUSTÍVEL, COMO FUNCIONA – Autoentusiastas. Acesso em 20 de Julho de 2021.
A seguir, temos um esquema da célula a combustível de gás hidrogênio.
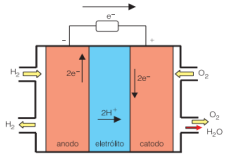
Esquema da célula a combustível de gás hidrogênio. Disponível em: www.usp.br/portalbiossistemas/?p=4316#:~:text=Em outras palavras%2C nessa célula a combustível a, célula a combustível é%3A H2 %2B ½O2→ H2O. Acesso em 20 de Julho de 2021.
A reação global balanceada da célula a combustível de gás hidrogênio é:
H2 (g) + ½O2 (g) → H2O (g)
Analisando o esquema da célula a combustível de gás hidrogênio (acima) e sua reação global balanceada, assinale a alternativa correta.
Adaptado. CÉLULA A COMBUSTÍVEL, COMO FUNCIONA – Autoentusiastas. Acesso em 20 de Julho de 2021.
A seguir, temos um esquema da célula a combustível de gás hidrogênio.

Esquema da célula a combustível de gás hidrogênio. Disponível em: www.usp.br/portalbiossistemas/?p=4316#:~:text=Em outras palavras%2C nessa célula a combustível a, célula a combustível é%3A H2 %2B ½O2→ H2O. Acesso em 20 de Julho de 2021.
A reação global balanceada da célula a combustível de gás hidrogênio é:
H2 (g) + ½O2 (g) → H2O (g)
Analisando o esquema da célula a combustível de gás hidrogênio (acima) e sua reação global balanceada, assinale a alternativa correta.
A pilha de lítio é usada em marca-passos implantados no interior da caixa torácica do paciente para controlar as batidas do coração por meio de impulso. Essa pilha é bastante leve, pesando apenas 25 g. Foi desenvolvida principalmente para ser utilizada em marca-passos, pois além de ter uma grande durabilidade (que pode chegar a até 10 anos), ela não solta gases que poderiam ser prejudiciais ao paciente, sendo fechada hermeticamente. Sua voltagem também é grande, variando de 2,8 V a 3,4 V. Sua constituição básica tem lítio metálico no ânodo e um complexo de iodo ou uma mistura de soluções, como por exemplo, o cloreto de sulfurila (SOCl2) no cátodo. Esses dois eletrodos sólidos são separados por uma camada cristalina de iodeto de lítio, por onde a corrente elétrica passa do ânodo para o cátodo.
Adaptado. Pilhas e Baterias de Lítio. Pilha e Baterias de íon lítio (uol.com.br). (Acesso em 23 de Julho de 2021).
Com relação à pilha de lítio usada em marca-passos e as transformações nela ocorridas, assinale a alternativa correta.
Adaptado. Pilhas e Baterias de Lítio. Pilha e Baterias de íon lítio (uol.com.br). (Acesso em 23 de Julho de 2021).
Com relação à pilha de lítio usada em marca-passos e as transformações nela ocorridas, assinale a alternativa correta.