Filtrar
64 Questões de concurso encontradas
Página 1 de 13
Questões por página:
Questões por página:
O níquel é um elemento de transição cujo principal íon é o Ni2+.
As configurações eletrônicas do átomo de níquel no estado fundamental e do íon Ni2+ correspondem, respectivamente, a
As configurações eletrônicas do átomo de níquel no estado fundamental e do íon Ni2+ correspondem, respectivamente, a
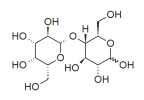
A intolerância a lactose tem se apresentado mais frequente na população. Sobre a lactose, cuja estrutura química é apresentada abaixo, é correto afirmar que:

Uma transição eletrônica envolve a transferência de um elétron de um orbital para outro. Tanto os átomos (orbitais atômicos) como as moléculas (orbitais moleculares) podem sofrer esse tipo de transição. A diferença de energia entre os orbitais 3s e 3p para o átomo de sódio é de 2,107 eV. Indique qual o comprimento de onda da radiação que será absorvida ao se excitar um elétron de um orbital 3s para o orbital 3p.
Dados:
Constante de Planck (h)=6,63 x 10-34 J s
1eV = 1,60 x 10-19 J)
Usando a teoria do orbital molecular podemos afirmar que:
Qual das seguintes sequências de hidretos de elementos do grupo 14 está em ordem crescente de estabilidade térmica?