Questões de Concurso
Filtrar
58 Questões de concurso encontradas
Página 5 de 12
Questões por página:
Questões por página:
Ao utilizar um calorímetro, podemos analisar a variação de calor ocorrida em uma reação química, ou seja, a variação de entalpia. Sabe-se que se reagirmos 0,04 mol de gás hidrogênio com 0,04 mol de gás cloro, teremos a formação de 0,08 mol de ácido clorídrico com liberação de 1.760 cal. Assinale a alternativa da entalpia de formação, em kcal/mol, do ácido clorídrico em condições padrão.
Um cientista colocou em uma câmara de reação de calorímetro uma mistura de gás hidrogênio e gás oxigênio, em que a partir de uma faísca houve a reação entre os gases. Nesta câmara, inicialmente, havia 500 g de água a uma temperatura de 20°C e, ao final da reação, a temperatura medida era de 23°C. Assinale a alternativa que corresponde, em kcal, ao calor de reação desta reação.
Questão Anulada
A partir das equações termodinâmicas a seguir, determine o calor padrão de formação do óxido de cobre sólido e assinale a alternativa que contém seu valor CORRETO.
2 Cu(s) + S(s) ? Cu2S(s) → Hº = - 79,5 kJ
S(s) + O2(g) Δ SO2(g) → Hº = - 297,0 kJ
Cu2S(s) + 2 O2(g) Δ 2 CuO(s) + SO2(g) → Hº = - 527,5 Kj
Os vapores liberados pelo material combustível sólido ou líquido entram em ignição quando em contato com uma fonte externa de calor, porém ao retirá-la, as chamas não se mantêm. A menor temperatura em que esse fenômeno ocorre é conhecida como:
Para que uma reação química possa ocorrer é necessário que os reagentes recebam certa quantidade de energia, chamada energia de ativação (Ea). A reação entre os gases nitrogênio e oxigênio, componentes do ar, por exemplo, não ocorre em condições ambientes, embora exista um grande número de choques entre suas moléculas. A reação entre esses gases ocorre na atmosfera apenas quando associada a descargas elétricas dos relâmpagos, em dias chuvosos, e também no interior dos motores de explosões internas, quando a vela do automóvel libera uma faísca elétrica. Nesses casos, a Ea é fornecida pelas faíscas.
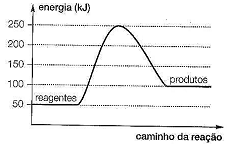
Considerando o gráfico anterior, referente ao diagrama energético de uma reação química, qual o valor da energia de ativação e o ΔH da reação respectivamente?

Considerando o gráfico anterior, referente ao diagrama energético de uma reação química, qual o valor da energia de ativação e o ΔH da reação respectivamente?