Questões de Concurso
Filtrar
2.837 Questões de concurso encontradas
Página 23 de 568
Questões por página:
Questões por página:
Disciplina:
Química
Na rotina de um laboratório de química, seja na academia ou na indústria, o uso de balanças analíticas é frequente. Por isso, é indispensável que o técnico saiba fazer o uso adequado desse instrumento, para que não ocorram erros significativos nas medições. Sobre a balança analítica, os seus componentes principais são:
Disciplina:
Química
Em um laboratório químico, é preciso conhecer as normas de segurança para evitar acidentes. Considere as afirmativas abaixo.
I. Frascos de ácido acético, de ácido nítrico e de ácido cianídrico podem ser acondicionados na mesma prateleira.
II. Frascos de éter etílico, de ácido clorídrico e de ácido fosfórico não devem ser acondicionados na mesma prateleira.
III. Os cilindros de oxigênio devem ser armazenados ao lado da capela.
É(São) verdadeira(s) a(s) seguinte(s) afirmativa(s)
I. Frascos de ácido acético, de ácido nítrico e de ácido cianídrico podem ser acondicionados na mesma prateleira.
II. Frascos de éter etílico, de ácido clorídrico e de ácido fosfórico não devem ser acondicionados na mesma prateleira.
III. Os cilindros de oxigênio devem ser armazenados ao lado da capela.
É(São) verdadeira(s) a(s) seguinte(s) afirmativa(s)
Disciplina:
Química
Considere a seguinte equação química não balanceada:

O coeficiente estequiométrico, a fórmula e o nome do composto X são, respectivamente:

O coeficiente estequiométrico, a fórmula e o nome do composto X são, respectivamente:
Disciplina:
Química
A água potável é a água saudável para o consumo humano, livre de microrganismos danosos e de compostos orgânicos e inorgânicos que causem efeitos fisiológicos adversos ou tenham sabor ruim. O processo para eliminação de patógenos é composto de
Disciplina:
Química
Usa-se hidróxido de cálcio, também conhecido como cal hidratada, no tratamento de águas, para eliminar a dureza temporária da água. Considere a reação química não balanceada abaixo:
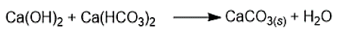
Considere as massas molares em g/mol: H= 1 g/mol, O= 16 g/mol e Ca= 40 g/mol. A massa de cal hidratada necessária para a obtenção de 350 mg de carbonato de cálcio é de
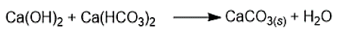
Considere as massas molares em g/mol: H= 1 g/mol, O= 16 g/mol e Ca= 40 g/mol. A massa de cal hidratada necessária para a obtenção de 350 mg de carbonato de cálcio é de