Questões de Concurso
Filtrar
515.374 Questões de concurso encontradas
Página 234 de 103.075
Questões por página:
Questões por página:
Concurso:
Prefeitura de Fazenda Rio Grande - PR
Disciplina:
Química
Considere um composto básico hipotético, forte, solúvel, nomeado Xa(OH)3, massa molar 55 g/mol. O preparo da solução Xa(OH)3 com concentração 0,01 mol/L resultará no pH aproximado de:
Dados: log 2=0,30, log 3= 0,48, log 5= 0,70
Dados: log 2=0,30, log 3= 0,48, log 5= 0,70
Concurso:
Prefeitura de Fazenda Rio Grande - PR
Disciplina:
Química
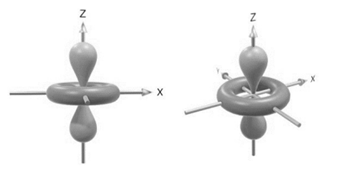
Assinale a alternativa que nomeia corretamente o orbital atômico apresentado nas imagens a seguir.

Concurso:
Prefeitura de Fazenda Rio Grande - PR
Disciplina:
Química
Acerca do cálculo da constante de equilíbrio (K) a partir de dados eletroquímicos, analise as assertivas e assinale a alternativa correta.
I. O valor de K pode ser obtido pela expressão matemática ln K = nFEcélula°/RT.
II. Quando K > 1 o valor de Ecélula° deverá ser menor que zero, caracterizando uma reação produto favorecida.
III. Para obter o valor de Ecélula° deve-se determinar Eredução°(Ânodo) - Eredução°(Cátodo).
I. O valor de K pode ser obtido pela expressão matemática ln K = nFEcélula°/RT.
II. Quando K > 1 o valor de Ecélula° deverá ser menor que zero, caracterizando uma reação produto favorecida.
III. Para obter o valor de Ecélula° deve-se determinar Eredução°(Ânodo) - Eredução°(Cátodo).
Concurso:
Prefeitura de Fazenda Rio Grande - PR
Disciplina:
Química
A organização dos elementos na tabela periódica é uma das mais notáveis realizações da química, pois permite a sistematização de propriedades que, de outra forma, estariam dispersas em um arranjo caótico. Sobre o desenvolvimento da tabela periódica, assinale a alternativa correta.
Concurso:
Prefeitura de Fazenda Rio Grande - PR
Disciplina:
Química
Considere a seguinte equação química não balanceada:
Fe2O3(s) + CO(g) → Fe(s) + CO2(g)
Se 26g de óxido férrico reagir com monóxido de carbono, a massa de ferro produzida será aproximadamente de:
Dados: Fe= 56 g/mol e Fe2O3= 160 g/mol.
Fe2O3(s) + CO(g) → Fe(s) + CO2(g)
Se 26g de óxido férrico reagir com monóxido de carbono, a massa de ferro produzida será aproximadamente de:
Dados: Fe= 56 g/mol e Fe2O3= 160 g/mol.